医药资讯
-
 三生制药贝伐珠单抗眼内注射溶液首次上市申请获受理 10月15日,三生制药宣布其自主研发的贝伐珠单抗眼内注射溶液(产品编号:601A,通用名:贝伐珠单抗眼内注射溶液)首个上市申请已被国家药监局受理,旨在治疗由视网膜分支静脉阻塞(BRVO)引起的黄斑水肿。这标志着三生制药在眼科药物领域的一项重要突破。 601A:重组抗VEGF人源化单抗 601A是一种重组抗血管内皮生长因子(VEGF)的人源化单克隆抗体。VEGF是导致视网膜新生血管形成和血管通透性增加的关键因子,进而促进黄斑水肿的发生。抗VEGF治疗已成为治疗黄斑水肿的关键手段,因此,601A作为一种创新治疗选择,具有极大的临床潜力。 III期临床研究结果显著 601A已成功完成了针对BRVO的III期临床研究,研究结果显示,经过24周的治疗,患者的最佳矫正视力(BCVA)相比基线有所提高,且效果与雷珠单抗相当。研究还表明,在治疗12周、24周和52周后,601A治疗组中,目标眼BCVA提高≥5个字母、≥10个字母和≥15个字母的患者比例与雷珠单抗组相似。此外,601A在中央视网膜厚度(CRT)变化等黄斑水肿改善指标上也展现出与雷珠单抗一致的疗效。 良好的安全性和耐受性 在安全性方面,601A在临床研究中展现了良好的耐受性和总体安全性,证明其治疗BRVO所致黄斑水肿的效果具有良好的获益与风险比,进一步为其广泛应用奠定基础。 视网膜分支静脉阻塞(BRVO)及黄斑水肿的临床挑战 视网膜静脉阻塞(RVO)是眼科常见的视网膜血管疾病,其中BRVO是最为常见的类型。BRVO的主要并发症包括黄斑水肿、视网膜及视盘新生血管形成、玻璃体出血及新生血管性青光眼等。黄斑水肿是导致视力下降的最常见原因,发生率高达48%~67%。若不及时治疗,黄斑水肿可能导致患者视力的永久性损害。 展望未来 601A的上市申请受理标志着三生制药在眼科治疗领域的进一步创新与突破。随着临床研究的不断推进和更多数据的积累,未来有望为更多BRVO患者提供新的治疗选择,有效改善其视力和生活质量。
三生制药贝伐珠单抗眼内注射溶液首次上市申请获受理 10月15日,三生制药宣布其自主研发的贝伐珠单抗眼内注射溶液(产品编号:601A,通用名:贝伐珠单抗眼内注射溶液)首个上市申请已被国家药监局受理,旨在治疗由视网膜分支静脉阻塞(BRVO)引起的黄斑水肿。这标志着三生制药在眼科药物领域的一项重要突破。 601A:重组抗VEGF人源化单抗 601A是一种重组抗血管内皮生长因子(VEGF)的人源化单克隆抗体。VEGF是导致视网膜新生血管形成和血管通透性增加的关键因子,进而促进黄斑水肿的发生。抗VEGF治疗已成为治疗黄斑水肿的关键手段,因此,601A作为一种创新治疗选择,具有极大的临床潜力。 III期临床研究结果显著 601A已成功完成了针对BRVO的III期临床研究,研究结果显示,经过24周的治疗,患者的最佳矫正视力(BCVA)相比基线有所提高,且效果与雷珠单抗相当。研究还表明,在治疗12周、24周和52周后,601A治疗组中,目标眼BCVA提高≥5个字母、≥10个字母和≥15个字母的患者比例与雷珠单抗组相似。此外,601A在中央视网膜厚度(CRT)变化等黄斑水肿改善指标上也展现出与雷珠单抗一致的疗效。 良好的安全性和耐受性 在安全性方面,601A在临床研究中展现了良好的耐受性和总体安全性,证明其治疗BRVO所致黄斑水肿的效果具有良好的获益与风险比,进一步为其广泛应用奠定基础。 视网膜分支静脉阻塞(BRVO)及黄斑水肿的临床挑战 视网膜静脉阻塞(RVO)是眼科常见的视网膜血管疾病,其中BRVO是最为常见的类型。BRVO的主要并发症包括黄斑水肿、视网膜及视盘新生血管形成、玻璃体出血及新生血管性青光眼等。黄斑水肿是导致视力下降的最常见原因,发生率高达48%~67%。若不及时治疗,黄斑水肿可能导致患者视力的永久性损害。 展望未来 601A的上市申请受理标志着三生制药在眼科治疗领域的进一步创新与突破。随着临床研究的不断推进和更多数据的积累,未来有望为更多BRVO患者提供新的治疗选择,有效改善其视力和生活质量。2025-10-16
-
 荣昌生物全球首创双靶点药物泰它西普申请新适应症:用于治疗IgA肾病 2025年10月14日,中国药品审评中心(CDE)官网更新了关于荣昌生物创新药物——泰它西普的新进展。该药物的新适应症申报已获得优先审评批准,针对原发性免疫球蛋白A(IgA)肾病成人患者,显著降低患者的蛋白尿水平。 泰它西普为IgA肾病带来新希望 原发性IgA肾病是一种常见的原发性肾小球疾病,全球范围内发病率逐年上升。根据弗若斯特沙利文的预测,全球IgA肾病患者数量将在2030年达到1016万人,其中中国的患者人数约为237万。这一疾病的主要特点是蛋白尿,若未得到及时有效治疗,30%-40%的患者可能发展为终末期肾病(ESRD),给患者带来严重的健康负担。 荣昌生物自主研发的泰它西普作为全球首个BLyS/APRIL双靶点融合蛋白,针对IgA肾病的临床需求,提供了新的治疗选择。泰它西普通过抑制B淋巴细胞刺激因子(BLyS)和增殖诱导配体(APRIL),有效减少免疫球蛋白的异常生成,从源头控制病程发展,减少肾脏免疫炎症反应。 临床数据支持:泰它西普显著降低蛋白尿 今年8月,泰它西普治疗IgA肾病的III期临床试验顺利完成,并达到了主要研究终点。试验包括318名成人IgA肾病患者,采用多中心、随机、双盲、安慰剂对照的研究设计,分为A、B两个阶段。A阶段的目标是评估泰它西普治疗前后患者24小时尿蛋白肌酐比值(UPCR)的变化。 研究结果显示,泰它西普组患者在39周治疗后,24小时UPCR减少了55%(P<0.0001),且患者耐受性良好,未出现明显不良反应。这一结果证实了泰它西普在减少蛋白尿方面的显著疗效,为IgA肾病患者提供了新的治疗希望。 免疫球蛋白A肾病的治疗挑战与泰它西普的创新之处 IgA肾病是一种慢性肾脏疾病,其特征是免疫复合物(主要为免疫球蛋白A)在肾脏沉积,导致肾小管和肾小球损伤。尽管传统治疗手段包括糖皮质激素和免疫抑制剂,但由于疗效有限,且存在较高的副作用,临床上急需新的靶向治疗药物。 泰它西普作为首个双靶点药物,通过同时抑制BLyS和APRIL两种重要免疫因子,有效减少了异常免疫反应,减轻了免疫复合物的沉积,开辟了新的治疗途径。 泰它西普的多项适应症:加速创新药物的发展 目前,泰它西普已获得中国药品监督管理局(NMPA)批准,用于治疗系统性红斑狼疮、类风湿性关节炎和重症肌无力等三项适应症。今年9月,泰它西普还获得了第四项新适应症——用于治疗原发性干燥综合征(pSS)的上市申请,成为全球首个在该领域申请上市的生物制药。 泰它西普的不断适应症扩展,标志着荣昌生物在创新药物研发方面的持续突破,也为国内外患者带来了更为多元的治疗选择。 小结:未来前景广阔,泰它西普助力IgA肾病治疗 泰它西普作为全球首个BLyS/APRIL双靶点药物,为治疗IgA肾病等免疫介导性疾病提供了新的武器。其在临床试验中展现的优异疗效和良好安全性,为IgA肾病患者带来了新的治疗希望。随着该药物新适应症的获批,荣昌生物正加速推动创新药物的研发与上市,进一步提升治疗方案的多样性和有效性。
荣昌生物全球首创双靶点药物泰它西普申请新适应症:用于治疗IgA肾病 2025年10月14日,中国药品审评中心(CDE)官网更新了关于荣昌生物创新药物——泰它西普的新进展。该药物的新适应症申报已获得优先审评批准,针对原发性免疫球蛋白A(IgA)肾病成人患者,显著降低患者的蛋白尿水平。 泰它西普为IgA肾病带来新希望 原发性IgA肾病是一种常见的原发性肾小球疾病,全球范围内发病率逐年上升。根据弗若斯特沙利文的预测,全球IgA肾病患者数量将在2030年达到1016万人,其中中国的患者人数约为237万。这一疾病的主要特点是蛋白尿,若未得到及时有效治疗,30%-40%的患者可能发展为终末期肾病(ESRD),给患者带来严重的健康负担。 荣昌生物自主研发的泰它西普作为全球首个BLyS/APRIL双靶点融合蛋白,针对IgA肾病的临床需求,提供了新的治疗选择。泰它西普通过抑制B淋巴细胞刺激因子(BLyS)和增殖诱导配体(APRIL),有效减少免疫球蛋白的异常生成,从源头控制病程发展,减少肾脏免疫炎症反应。 临床数据支持:泰它西普显著降低蛋白尿 今年8月,泰它西普治疗IgA肾病的III期临床试验顺利完成,并达到了主要研究终点。试验包括318名成人IgA肾病患者,采用多中心、随机、双盲、安慰剂对照的研究设计,分为A、B两个阶段。A阶段的目标是评估泰它西普治疗前后患者24小时尿蛋白肌酐比值(UPCR)的变化。 研究结果显示,泰它西普组患者在39周治疗后,24小时UPCR减少了55%(P<0.0001),且患者耐受性良好,未出现明显不良反应。这一结果证实了泰它西普在减少蛋白尿方面的显著疗效,为IgA肾病患者提供了新的治疗希望。 免疫球蛋白A肾病的治疗挑战与泰它西普的创新之处 IgA肾病是一种慢性肾脏疾病,其特征是免疫复合物(主要为免疫球蛋白A)在肾脏沉积,导致肾小管和肾小球损伤。尽管传统治疗手段包括糖皮质激素和免疫抑制剂,但由于疗效有限,且存在较高的副作用,临床上急需新的靶向治疗药物。 泰它西普作为首个双靶点药物,通过同时抑制BLyS和APRIL两种重要免疫因子,有效减少了异常免疫反应,减轻了免疫复合物的沉积,开辟了新的治疗途径。 泰它西普的多项适应症:加速创新药物的发展 目前,泰它西普已获得中国药品监督管理局(NMPA)批准,用于治疗系统性红斑狼疮、类风湿性关节炎和重症肌无力等三项适应症。今年9月,泰它西普还获得了第四项新适应症——用于治疗原发性干燥综合征(pSS)的上市申请,成为全球首个在该领域申请上市的生物制药。 泰它西普的不断适应症扩展,标志着荣昌生物在创新药物研发方面的持续突破,也为国内外患者带来了更为多元的治疗选择。 小结:未来前景广阔,泰它西普助力IgA肾病治疗 泰它西普作为全球首个BLyS/APRIL双靶点药物,为治疗IgA肾病等免疫介导性疾病提供了新的武器。其在临床试验中展现的优异疗效和良好安全性,为IgA肾病患者带来了新的治疗希望。随着该药物新适应症的获批,荣昌生物正加速推动创新药物的研发与上市,进一步提升治疗方案的多样性和有效性。2025-10-15
-
 GSK重组带状疱疹疫苗在华获批新适应症:免疫缺陷人群迎来防护新选择 10月14日,葛兰素史克(GSK)宣布,其重组带状疱疹疫苗——欣安立适(RZV,CHO细胞),已正式获得中国国家药品监督管理局(NMPA)批准,用于18岁及以上因疾病或治疗导致免疫功能受损的成人预防带状疱疹。这一扩展适应症包括接受自体造血干细胞移植等治疗后免疫力下降的人群。 带状疱疹负担沉重,免疫受损者风险更高 在中国,每年约有600万人罹患带状疱疹。该疾病不仅会引起剧烈的皮肤疼痛,还常伴随酸胀、灼热、刺痛或电击般疼痛感,严重影响睡眠与日常生活质量。 除年龄增长外,免疫缺陷与免疫抑制是导致带状疱疹高发的重要因素。然而,在此次GSK产品获批之前,中国尚无其他适用于该类人群的带状疱疹疫苗。 欣安立适的适应症扩展,意味着更多高风险患者将获得科学有效的预防手段,从而减轻疾病负担。 GSK:推动预防优先的公共卫生格局 GSK高级副总裁、疫苗与传染病研发负责人 Sanjay Gurunathan 表示: “此次批准是我们在扩大欣安立适可及性方面的重要一步。对于免疫功能受损的患者而言,带状疱疹的危害更为严重。我们将持续与监管机构紧密合作,推动创新防护手段,让医疗体系更注重‘预防先行’。” 全球首创方案在华落地,填补防控空白 作为首个也是目前唯一获批用于免疫缺陷或免疫抑制人群的重组带状疱疹疫苗,欣安立适的上市被认为填补了重要的防控缺口。 GSK中国副总裁兼总经理 余慧明 表示: “这一适应症的扩展将帮助免疫受损人群更好地应对带状疱疹威胁,并为成人疫苗体系建设注入新动力。GSK将继续践行‘合力超越,共克疾病’的使命,推动‘医防融合’,助力‘健康中国2030’目标的实现。” 临床数据支撑:六项试验证实有效与安全 本次适应症申请基于六项国际多中心临床试验数据。 研究涵盖18岁及以上的高风险人群,包括: 近期接受造血干细胞或肾脏移植者; 血液系统恶性肿瘤或实体瘤患者; 以及HIV感染人群。 结果显示,RZV在这些免疫受损群体中可显著降低带状疱疹发病风险,并具备良好的安全性。 从治疗到预防:疫苗战略升级 欣安立适的获批,标志着GSK在中国免疫领域迈出关键一步。公司计划通过构建覆盖全生命周期的“预防—治疗”一体化体系,加强疫苗创新与疾病防控协同,为中国成人免疫接种体系发展提供支持。 GSK方面表示,将持续携手医疗机构、科研单位与政府部门,共同推动公共卫生体系升级,让更多高风险人群享受到科学防护的成果。 总结: 随着欣安立适扩展适应症在中国获批,免疫功能受损者迎来了首个可用的重组带状疱疹疫苗。这不仅填补了临床防控空白,也进一步推动了我国成人免疫体系从“治疗导向”向“预防优先”的转变。
GSK重组带状疱疹疫苗在华获批新适应症:免疫缺陷人群迎来防护新选择 10月14日,葛兰素史克(GSK)宣布,其重组带状疱疹疫苗——欣安立适(RZV,CHO细胞),已正式获得中国国家药品监督管理局(NMPA)批准,用于18岁及以上因疾病或治疗导致免疫功能受损的成人预防带状疱疹。这一扩展适应症包括接受自体造血干细胞移植等治疗后免疫力下降的人群。 带状疱疹负担沉重,免疫受损者风险更高 在中国,每年约有600万人罹患带状疱疹。该疾病不仅会引起剧烈的皮肤疼痛,还常伴随酸胀、灼热、刺痛或电击般疼痛感,严重影响睡眠与日常生活质量。 除年龄增长外,免疫缺陷与免疫抑制是导致带状疱疹高发的重要因素。然而,在此次GSK产品获批之前,中国尚无其他适用于该类人群的带状疱疹疫苗。 欣安立适的适应症扩展,意味着更多高风险患者将获得科学有效的预防手段,从而减轻疾病负担。 GSK:推动预防优先的公共卫生格局 GSK高级副总裁、疫苗与传染病研发负责人 Sanjay Gurunathan 表示: “此次批准是我们在扩大欣安立适可及性方面的重要一步。对于免疫功能受损的患者而言,带状疱疹的危害更为严重。我们将持续与监管机构紧密合作,推动创新防护手段,让医疗体系更注重‘预防先行’。” 全球首创方案在华落地,填补防控空白 作为首个也是目前唯一获批用于免疫缺陷或免疫抑制人群的重组带状疱疹疫苗,欣安立适的上市被认为填补了重要的防控缺口。 GSK中国副总裁兼总经理 余慧明 表示: “这一适应症的扩展将帮助免疫受损人群更好地应对带状疱疹威胁,并为成人疫苗体系建设注入新动力。GSK将继续践行‘合力超越,共克疾病’的使命,推动‘医防融合’,助力‘健康中国2030’目标的实现。” 临床数据支撑:六项试验证实有效与安全 本次适应症申请基于六项国际多中心临床试验数据。 研究涵盖18岁及以上的高风险人群,包括: 近期接受造血干细胞或肾脏移植者; 血液系统恶性肿瘤或实体瘤患者; 以及HIV感染人群。 结果显示,RZV在这些免疫受损群体中可显著降低带状疱疹发病风险,并具备良好的安全性。 从治疗到预防:疫苗战略升级 欣安立适的获批,标志着GSK在中国免疫领域迈出关键一步。公司计划通过构建覆盖全生命周期的“预防—治疗”一体化体系,加强疫苗创新与疾病防控协同,为中国成人免疫接种体系发展提供支持。 GSK方面表示,将持续携手医疗机构、科研单位与政府部门,共同推动公共卫生体系升级,让更多高风险人群享受到科学防护的成果。 总结: 随着欣安立适扩展适应症在中国获批,免疫功能受损者迎来了首个可用的重组带状疱疹疫苗。这不仅填补了临床防控空白,也进一步推动了我国成人免疫体系从“治疗导向”向“预防优先”的转变。2025-10-15
-
 和美药业莫米司特(Hemay005)正式获批上市:聚焦斑块状银屑病治疗新选择 10月11日,国家药品监督管理局官网最新公示显示,和美药业自主研发的莫米司特(Hemay005)正式获批上市。根据现有临床研究进展推测,本次获批的适应症为斑块状银屑病,标志着该领域又迎来一款国产创新小分子药物。 靶向PDE4通路,小分子抑制剂助力炎症疾病治疗 莫米司特是一款由和美药业自主研发的磷酸二酯酶4(PDE4)抑制剂。 PDE4在调节细胞内cAMP和cGMP水平方面发挥关键作用,通过该通路可影响多种炎症因子的产生。抑制PDE4的活性可有效减轻炎症反应,因此该靶点已成为治疗银屑病、白塞氏病及其他炎症性疾病的重要方向。 历时八年研发,Ⅲ期研究结果表现突出 自2016年12月首次进入临床阶段以来,莫米司特已完成多项关键性研究。 在两项Ⅲ期临床试验中,研究团队分别评估了其在斑块状银屑病和白塞氏病中的疗效与安全性。 其中,针对斑块状银屑病的Ⅲ期研究显示,莫米司特(60mg,每日两次)显著改善患者病情,主要疗效终点已顺利达成。 结果显示,莫米司特治疗组达到PASI-75的患者比例高达53.6%,而安慰剂组仅为16.0%,差异具有高度统计学意义。 国际会议亮相,白塞氏病疗效获肯定 2023年11月,和美药业在美国风湿病学会(ACR)年会上公布了莫米司特治疗白塞氏病的Ⅱ期临床结果。 这项随机、双盲、安慰剂对照试验共入组90例患者,结果显示:莫米司特45mg与60mg剂量组在减少口腔溃疡数量方面均显著优于安慰剂组(P<0.0001)。 根据Kaplan-Meier分析,45mg组患者口腔溃疡的中位愈合时间为16天,60mg组为15天,而安慰剂组因疗效不足无法计算中位时间。 安全性良好,不良反应可控 在安全性方面,12周核心治疗期数据显示,药物相关不良事件(TEAEs)导致的停药率在45mg组和60mg组分别为6.9%与6.7%,虽略高于安慰剂组(0%),但多数不良反应为轻度,且严重不良事件发生率较低。 整体来看,莫米司特展现出良好的耐受性和安全特征,为后续临床应用奠定基础。 国产PDE4抑制剂迎来突破,填补国内治疗空白 目前,全球共有5款选择性PDE4抑制剂已上市,但大多为海外企业研发产品。 在中国,仅阿普米司特片(安进/BMS)获批用于治疗斑块状银屑病。 此次莫米司特的成功上市,不仅填补了国内PDE4抑制剂在银屑病治疗领域的空白,也标志着和美药业在炎症性疾病领域的创新研发迈上新台阶。
和美药业莫米司特(Hemay005)正式获批上市:聚焦斑块状银屑病治疗新选择 10月11日,国家药品监督管理局官网最新公示显示,和美药业自主研发的莫米司特(Hemay005)正式获批上市。根据现有临床研究进展推测,本次获批的适应症为斑块状银屑病,标志着该领域又迎来一款国产创新小分子药物。 靶向PDE4通路,小分子抑制剂助力炎症疾病治疗 莫米司特是一款由和美药业自主研发的磷酸二酯酶4(PDE4)抑制剂。 PDE4在调节细胞内cAMP和cGMP水平方面发挥关键作用,通过该通路可影响多种炎症因子的产生。抑制PDE4的活性可有效减轻炎症反应,因此该靶点已成为治疗银屑病、白塞氏病及其他炎症性疾病的重要方向。 历时八年研发,Ⅲ期研究结果表现突出 自2016年12月首次进入临床阶段以来,莫米司特已完成多项关键性研究。 在两项Ⅲ期临床试验中,研究团队分别评估了其在斑块状银屑病和白塞氏病中的疗效与安全性。 其中,针对斑块状银屑病的Ⅲ期研究显示,莫米司特(60mg,每日两次)显著改善患者病情,主要疗效终点已顺利达成。 结果显示,莫米司特治疗组达到PASI-75的患者比例高达53.6%,而安慰剂组仅为16.0%,差异具有高度统计学意义。 国际会议亮相,白塞氏病疗效获肯定 2023年11月,和美药业在美国风湿病学会(ACR)年会上公布了莫米司特治疗白塞氏病的Ⅱ期临床结果。 这项随机、双盲、安慰剂对照试验共入组90例患者,结果显示:莫米司特45mg与60mg剂量组在减少口腔溃疡数量方面均显著优于安慰剂组(P<0.0001)。 根据Kaplan-Meier分析,45mg组患者口腔溃疡的中位愈合时间为16天,60mg组为15天,而安慰剂组因疗效不足无法计算中位时间。 安全性良好,不良反应可控 在安全性方面,12周核心治疗期数据显示,药物相关不良事件(TEAEs)导致的停药率在45mg组和60mg组分别为6.9%与6.7%,虽略高于安慰剂组(0%),但多数不良反应为轻度,且严重不良事件发生率较低。 整体来看,莫米司特展现出良好的耐受性和安全特征,为后续临床应用奠定基础。 国产PDE4抑制剂迎来突破,填补国内治疗空白 目前,全球共有5款选择性PDE4抑制剂已上市,但大多为海外企业研发产品。 在中国,仅阿普米司特片(安进/BMS)获批用于治疗斑块状银屑病。 此次莫米司特的成功上市,不仅填补了国内PDE4抑制剂在银屑病治疗领域的空白,也标志着和美药业在炎症性疾病领域的创新研发迈上新台阶。2025-10-14
-
 石药集团依达格鲁肽α注射液获NMPA受理:有望成为减重新选择 10月13日,石药集团正式公告,其研发的依达格鲁肽α注射液的新药上市申请已被国家药品监督管理局(NMPA)受理。该药按“治疗用生物制品1类新药”路径申报,拟用于在合理饮食与运动干预基础上,帮助超重或肥胖成人进行长期体重管理。 每周一次给药,作用机制多重受益 依达格鲁肽α是一种重组人源GLP-1(胰高血糖素样肽-1)Fc融合蛋白制剂,采用每周一次皮下注射的方式。 该药通过激活GLP-1受体,能够抑制食欲、减少能量摄入,并以葡萄糖浓度依赖性方式降低血糖水平。此外,研究显示该药还可改善患者的心血管代谢健康,具有综合治疗潜力。 临床试验证实显著疗效 石药集团的III期关键临床试验入组了肥胖或伴有代谢性并发症的超重成人。研究结果表明,与安慰剂相比,依达格鲁肽α能带来显著的体重下降,并明显改善腰围、血糖、血压、血脂等多项代谢指标,提示该药在体重与心血管风险双重控制方面具备临床优势。 安全性良好,剂量递增更便捷 临床数据显示,依达格鲁肽α的耐受性较优,胃肠道不良反应发生率相对较低。与市场上已上市的同类GLP-1药物相比,其剂量递增周期更短,仅需4周即可达到维持剂量,给患者带来更简化的用药体验。 石药集团加码GLP-1赛道布局 值得关注的是,石药集团不仅推进依达格鲁肽α的创新药研发,其仿制版司美格鲁肽也已于今年8月递交上市申请。随着两款产品的推进,石药集团正加速完善GLP-1创新与仿制药并行的减重与代谢疾病产品矩阵,有望在快速增长的体重管理领域占据一席之地。
石药集团依达格鲁肽α注射液获NMPA受理:有望成为减重新选择 10月13日,石药集团正式公告,其研发的依达格鲁肽α注射液的新药上市申请已被国家药品监督管理局(NMPA)受理。该药按“治疗用生物制品1类新药”路径申报,拟用于在合理饮食与运动干预基础上,帮助超重或肥胖成人进行长期体重管理。 每周一次给药,作用机制多重受益 依达格鲁肽α是一种重组人源GLP-1(胰高血糖素样肽-1)Fc融合蛋白制剂,采用每周一次皮下注射的方式。 该药通过激活GLP-1受体,能够抑制食欲、减少能量摄入,并以葡萄糖浓度依赖性方式降低血糖水平。此外,研究显示该药还可改善患者的心血管代谢健康,具有综合治疗潜力。 临床试验证实显著疗效 石药集团的III期关键临床试验入组了肥胖或伴有代谢性并发症的超重成人。研究结果表明,与安慰剂相比,依达格鲁肽α能带来显著的体重下降,并明显改善腰围、血糖、血压、血脂等多项代谢指标,提示该药在体重与心血管风险双重控制方面具备临床优势。 安全性良好,剂量递增更便捷 临床数据显示,依达格鲁肽α的耐受性较优,胃肠道不良反应发生率相对较低。与市场上已上市的同类GLP-1药物相比,其剂量递增周期更短,仅需4周即可达到维持剂量,给患者带来更简化的用药体验。 石药集团加码GLP-1赛道布局 值得关注的是,石药集团不仅推进依达格鲁肽α的创新药研发,其仿制版司美格鲁肽也已于今年8月递交上市申请。随着两款产品的推进,石药集团正加速完善GLP-1创新与仿制药并行的减重与代谢疾病产品矩阵,有望在快速增长的体重管理领域占据一席之地。2025-10-14
-
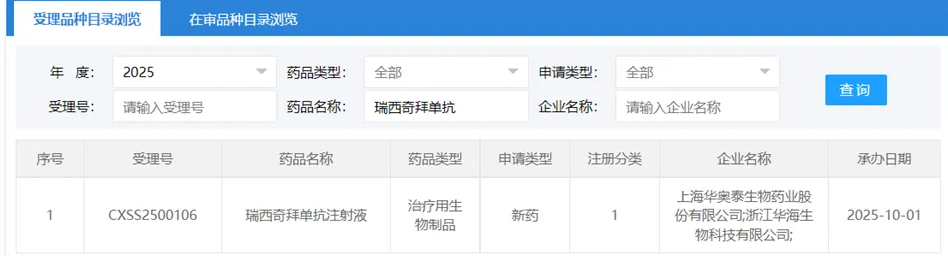 华奥泰瑞西奇拜单抗上市申请获受理 聚焦罕见病GPP治疗 2025年10月1日,国家药品监督管理局药品审评中心(CDE)官网显示,华奥泰自主研发的1类创新药——瑞西奇拜单抗注射液的上市申请正式获受理。该药物于2025年8月被纳入优先审评,用于治疗成人泛发性脓疱型银屑病(GPP)急性发作。此外,瑞西奇拜单抗还曾获美国FDA授予治疗GPP的孤儿药资格。这款新药的推出,将为国内治疗这一罕见病带来重要突破。 GPP:病症特点与治疗需求 泛发性脓疱型银屑病(GPP)是一种罕见、可威胁生命的系统性中性粒细胞性皮肤病。其急性发作时,患者常出现全身红斑、脓疱,并伴有发热、关节痛、肌痛、C反应蛋白升高以及白细胞增多等系统性炎症症状。由于发作与死亡直接相关,若不及时控制病情,可能导致败血症和多系统器官衰竭,危及生命。因此,如何快速控制GPP急性发作成为治疗的关键。 2023年,GPP被纳入中国《第二批罕见病目录》。尽管病因和发病机制尚未完全明了,但研究表明,IL-36信号通路的过度激活是GPP发病的重要机制。靶向该通路的治疗药物因此成为潜在疗法。 瑞西奇拜单抗:靶向IL-36R的创新疗法 瑞西奇拜单抗(HB0034)是一款靶向IL-36R的IgG1型人源化单克隆抗体,由华奥泰自主研发。该药物通过精准阻断IL-36信号通路,有效抑制炎症因子的释放以及中性粒细胞的浸润,从而快速缓解GPP急性发作。 与目前已上市的治疗药物佩索利单抗(Spesolimab)相比,瑞西奇拜单抗的特点如下: 精准阻断IL-36R激活:通过抑制IL-36信号通路,从病理机制上控制GPP发作; 优先审评:药物创新性被认可,上市进程加速; 孤儿药资格:获FDA认证,为罕见病治疗领域的国际竞争力提供支持。 全球治疗现状:佩索利单抗的启示 目前,全球治疗GPP的药物中,仅有勃林格殷格翰的佩索利单抗获批。其通过特异性阻断IL-36R,抑制病理级联反应,为急性发作的患者提供了有效治疗。 佩索利单抗的市场布局: 静脉注射剂型:2022年12月被NMPA批准用于治疗成人GPP急性发作; 皮下注射剂型:2024年3月被NMPA批准用于减少12岁及以上青少年(体重≥40kg)以及成人患者的GPP发作。 佩索利单抗的临床应用为瑞西奇拜单抗的研发方向提供了重要参考,也展示了IL-36R靶向疗法的巨大潜力。 未来展望:瑞西奇拜单抗的临床意义 瑞西奇拜单抗作为国产创新药物,一旦获批上市,将填补国内在IL-36R抗体疗法领域的空白,为GPP患者提供新的治疗选择。以下为其潜在临床和市场意义: 提升治疗可及性:通过国产药物的研发与上市,降低患者的经济负担,扩大治疗覆盖范围; 推动罕见病创新:自主研发药物的成功经验,将加速国内罕见病治疗体系的完善; 国际市场竞争:借助孤儿药资格认证,瑞西奇拜单抗有望进军国际市场,与外资药物抗衡。 结语 随着华奥泰瑞西奇拜单抗上市申请的获受理,国内GPP治疗领域迎来了重要转折点。这款创新药物代表了国产企业在罕见病治疗中的技术突破,同时为GPP患者带来新的治疗希望。未来,随着上市进程的推进,瑞西奇拜单抗将为快速控制GPP急性发作提供更高效的解决方案,并进一步推动国产药物在国际舞台上的竞争力提升。
华奥泰瑞西奇拜单抗上市申请获受理 聚焦罕见病GPP治疗 2025年10月1日,国家药品监督管理局药品审评中心(CDE)官网显示,华奥泰自主研发的1类创新药——瑞西奇拜单抗注射液的上市申请正式获受理。该药物于2025年8月被纳入优先审评,用于治疗成人泛发性脓疱型银屑病(GPP)急性发作。此外,瑞西奇拜单抗还曾获美国FDA授予治疗GPP的孤儿药资格。这款新药的推出,将为国内治疗这一罕见病带来重要突破。 GPP:病症特点与治疗需求 泛发性脓疱型银屑病(GPP)是一种罕见、可威胁生命的系统性中性粒细胞性皮肤病。其急性发作时,患者常出现全身红斑、脓疱,并伴有发热、关节痛、肌痛、C反应蛋白升高以及白细胞增多等系统性炎症症状。由于发作与死亡直接相关,若不及时控制病情,可能导致败血症和多系统器官衰竭,危及生命。因此,如何快速控制GPP急性发作成为治疗的关键。 2023年,GPP被纳入中国《第二批罕见病目录》。尽管病因和发病机制尚未完全明了,但研究表明,IL-36信号通路的过度激活是GPP发病的重要机制。靶向该通路的治疗药物因此成为潜在疗法。 瑞西奇拜单抗:靶向IL-36R的创新疗法 瑞西奇拜单抗(HB0034)是一款靶向IL-36R的IgG1型人源化单克隆抗体,由华奥泰自主研发。该药物通过精准阻断IL-36信号通路,有效抑制炎症因子的释放以及中性粒细胞的浸润,从而快速缓解GPP急性发作。 与目前已上市的治疗药物佩索利单抗(Spesolimab)相比,瑞西奇拜单抗的特点如下: 精准阻断IL-36R激活:通过抑制IL-36信号通路,从病理机制上控制GPP发作; 优先审评:药物创新性被认可,上市进程加速; 孤儿药资格:获FDA认证,为罕见病治疗领域的国际竞争力提供支持。 全球治疗现状:佩索利单抗的启示 目前,全球治疗GPP的药物中,仅有勃林格殷格翰的佩索利单抗获批。其通过特异性阻断IL-36R,抑制病理级联反应,为急性发作的患者提供了有效治疗。 佩索利单抗的市场布局: 静脉注射剂型:2022年12月被NMPA批准用于治疗成人GPP急性发作; 皮下注射剂型:2024年3月被NMPA批准用于减少12岁及以上青少年(体重≥40kg)以及成人患者的GPP发作。 佩索利单抗的临床应用为瑞西奇拜单抗的研发方向提供了重要参考,也展示了IL-36R靶向疗法的巨大潜力。 未来展望:瑞西奇拜单抗的临床意义 瑞西奇拜单抗作为国产创新药物,一旦获批上市,将填补国内在IL-36R抗体疗法领域的空白,为GPP患者提供新的治疗选择。以下为其潜在临床和市场意义: 提升治疗可及性:通过国产药物的研发与上市,降低患者的经济负担,扩大治疗覆盖范围; 推动罕见病创新:自主研发药物的成功经验,将加速国内罕见病治疗体系的完善; 国际市场竞争:借助孤儿药资格认证,瑞西奇拜单抗有望进军国际市场,与外资药物抗衡。 结语 随着华奥泰瑞西奇拜单抗上市申请的获受理,国内GPP治疗领域迎来了重要转折点。这款创新药物代表了国产企业在罕见病治疗中的技术突破,同时为GPP患者带来新的治疗希望。未来,随着上市进程的推进,瑞西奇拜单抗将为快速控制GPP急性发作提供更高效的解决方案,并进一步推动国产药物在国际舞台上的竞争力提升。2025-10-11
-
 Incyte启动CDK2抑制剂INCB123667首个III期试验 聚焦铂耐药卵巢癌治疗 2025年10月9日,全球临床试验收录网站显示,Incyte已启动了其CDK2抑制剂INCB123667的首个III期临床试验(MAESTRA 2)。该药物是全球首个进入III期阶段的CDK2抑制剂,为铂耐药卵巢癌患者提供了一种潜在的新型治疗选择。 MAESTRA 2研究设计:评估疗效与安全性 MAESTRA 2是一项随机、开放标签的临床试验,计划纳入466名伴有细胞周期蛋白E1过表达的铂耐药卵巢癌患者。 研究目标:评估INCB123667根据研究者选择的化疗方案的有效性和安全性; 主要终点:无进展生存期(PFS)和总生存期(OS); 试验背景:铂耐药卵巢癌患者治疗选择有限,而INCB123667靶向细胞周期蛋白E1和CDK2通路,为这类患者群体带来新的希望。 I期研究数据:治疗效果初步验证 此前,Incyte在2025年ASCO大会上发布了INCB123667治疗铂耐药卵巢癌的I期临床试验结果,展现了令人鼓舞的数据: 客观缓解率(ORR):90名患者中有19例实现客观缓解(ORR为21.1%),其中4例为完全缓解、15例部分缓解; 安全性分析:38例患者出现3级及以上治疗期间不良事件(TEAE,占42.2%),其中最常见的不良事件包括: 肠梗阻(n=8); 贫血(n=6); 中性粒细胞减少(n=5); 血小板减少(n=5)。 治疗依从性:3例患者因TEAE停止治疗,占比3.3%,显示药物总体耐受性较好。 CDK2抑制剂研发概况:竞争加剧 CDK2激酶作为细胞周期调控的重要靶点,与多种肿瘤的发生密切相关,特别是细胞周期蛋白E1过表达的肿瘤,包括铂耐药卵巢癌。目前,全球共有58款CDK2抑制剂处于研发中,其中10款已进入临床阶段,研发进度领先的包括: INCB123667(Incyte):首个进入III期试验的CDK2抑制剂; Tagtociclib(辉瑞):研发进度紧随其后,同样表现出强大的临床潜能。 随着CDK2抑制剂领域竞争加剧,INCB123667的临床试验进展将为这一领域的未来发展提供重要参考。 未来展望:铂耐药卵巢癌治疗新希望 铂耐药卵巢癌是目前治疗难度较大的癌症类型,病情复发和耐药问题显著影响患者预后。INCB123667的III期试验为该领域的治疗创新注入新的动力: 治疗选择扩展:如果MAESTRA 2研究结果显示出明显的疗效与安全性,INCB123667有望成为铂耐药卵巢癌的一线治疗方案; 靶向治疗前景:针对细胞周期调控的CDK2通路,药物研发的成功或将打开更多癌症治疗的突破点; 全球市场竞争:INCB123667作为首个进入III期的CDK2抑制剂,其结果将影响后续竞争者的研发方向与策略。 总结 Incyte启动CDK2抑制剂INCB123667的首个III期临床试验,标志着这一药物在铂耐药卵巢癌治疗领域迈向重要里程碑。此前的I期研究数据已验证了其治疗效果与耐受性,III期临床试验将进一步明确其疗效与安全性,为难治性卵巢癌提供新的治疗选择。同时,这一试验也加速了CDK2靶点药物的全球发展,推动癌症靶向治疗领域迈向更广阔的前景。
Incyte启动CDK2抑制剂INCB123667首个III期试验 聚焦铂耐药卵巢癌治疗 2025年10月9日,全球临床试验收录网站显示,Incyte已启动了其CDK2抑制剂INCB123667的首个III期临床试验(MAESTRA 2)。该药物是全球首个进入III期阶段的CDK2抑制剂,为铂耐药卵巢癌患者提供了一种潜在的新型治疗选择。 MAESTRA 2研究设计:评估疗效与安全性 MAESTRA 2是一项随机、开放标签的临床试验,计划纳入466名伴有细胞周期蛋白E1过表达的铂耐药卵巢癌患者。 研究目标:评估INCB123667根据研究者选择的化疗方案的有效性和安全性; 主要终点:无进展生存期(PFS)和总生存期(OS); 试验背景:铂耐药卵巢癌患者治疗选择有限,而INCB123667靶向细胞周期蛋白E1和CDK2通路,为这类患者群体带来新的希望。 I期研究数据:治疗效果初步验证 此前,Incyte在2025年ASCO大会上发布了INCB123667治疗铂耐药卵巢癌的I期临床试验结果,展现了令人鼓舞的数据: 客观缓解率(ORR):90名患者中有19例实现客观缓解(ORR为21.1%),其中4例为完全缓解、15例部分缓解; 安全性分析:38例患者出现3级及以上治疗期间不良事件(TEAE,占42.2%),其中最常见的不良事件包括: 肠梗阻(n=8); 贫血(n=6); 中性粒细胞减少(n=5); 血小板减少(n=5)。 治疗依从性:3例患者因TEAE停止治疗,占比3.3%,显示药物总体耐受性较好。 CDK2抑制剂研发概况:竞争加剧 CDK2激酶作为细胞周期调控的重要靶点,与多种肿瘤的发生密切相关,特别是细胞周期蛋白E1过表达的肿瘤,包括铂耐药卵巢癌。目前,全球共有58款CDK2抑制剂处于研发中,其中10款已进入临床阶段,研发进度领先的包括: INCB123667(Incyte):首个进入III期试验的CDK2抑制剂; Tagtociclib(辉瑞):研发进度紧随其后,同样表现出强大的临床潜能。 随着CDK2抑制剂领域竞争加剧,INCB123667的临床试验进展将为这一领域的未来发展提供重要参考。 未来展望:铂耐药卵巢癌治疗新希望 铂耐药卵巢癌是目前治疗难度较大的癌症类型,病情复发和耐药问题显著影响患者预后。INCB123667的III期试验为该领域的治疗创新注入新的动力: 治疗选择扩展:如果MAESTRA 2研究结果显示出明显的疗效与安全性,INCB123667有望成为铂耐药卵巢癌的一线治疗方案; 靶向治疗前景:针对细胞周期调控的CDK2通路,药物研发的成功或将打开更多癌症治疗的突破点; 全球市场竞争:INCB123667作为首个进入III期的CDK2抑制剂,其结果将影响后续竞争者的研发方向与策略。 总结 Incyte启动CDK2抑制剂INCB123667的首个III期临床试验,标志着这一药物在铂耐药卵巢癌治疗领域迈向重要里程碑。此前的I期研究数据已验证了其治疗效果与耐受性,III期临床试验将进一步明确其疗效与安全性,为难治性卵巢癌提供新的治疗选择。同时,这一试验也加速了CDK2靶点药物的全球发展,推动癌症靶向治疗领域迈向更广阔的前景。2025-10-11
-
 武田宣布聚焦核心领域 停止细胞疗法研发 2025年10月1日,武田制药宣布,在对战略产品组合进行优先级排序后,公司决定停止其细胞疗法领域的研发工作。这一决定旨在优化资源配置,将近期投资集中于能够以更快速度和规模为患者提供变革性疗法的领域。 寻求外部合作伙伴 推进细胞疗法研究 尽管武田决定退出细胞疗法领域的内部开发工作,公司仍计划通过外部合作伙伴利用其细胞疗法平台技术。武田希望借助合作伙伴推进其现有的研究及临床就绪项目,使这些创新继续造福于患者和医学发展。 目前,武田没有正在开展临床试验的细胞疗法相关产品,但其此前在细胞疗法研究中积累的经验与技术,将继续用于支持其他领域的临床前研究项目。 战略聚焦核心领域 武田决定将研发重点放在更具市场潜力的项目上,包括小分子、生物制剂和抗体药物偶联物(ADC)药物开发。公司希望这些领域的突破性项目,能以更高效率和更大规模满足患者对创新疗法的需求。武田的临床前项目将继续受益于其在细胞疗法研究中获得的宝贵见解,为未来候选治疗药物的开发提供支持。 财务影响:减值损失约580亿日元 武田预计在2025财年第二季度(截至2026年3月31日的财年)将确认约580亿日元的减值损失,主要与其γ-δ T细胞治疗平台相关的无形资产有关。这部分影响已包含在公司于2025年5月8日公布的全年合并预测中,其中涉及约500亿日元的无形资产减值损失。 武田表示,将继续评估任何其他潜在财务影响,并在必要情况下于2025年10月30日第二季度财务业绩报告中反映相关调整。 未来展望:聚焦创新药物开发 武田的决定标志着公司战略调整的关键一步。通过在小分子、生物制剂和ADC药物领域的集中投入,武田希望巩固其在创新医药研发领域的核心竞争力。尽管停止细胞疗法内部开发会带来短期财务上的影响,公司仍对通过合作伙伴推进研发充满信心。未来,武田将继续专注于能够为患者提供突破性疗法的领域,推动关键项目走向临床成果,实现更广泛的全球医疗影响力。
武田宣布聚焦核心领域 停止细胞疗法研发 2025年10月1日,武田制药宣布,在对战略产品组合进行优先级排序后,公司决定停止其细胞疗法领域的研发工作。这一决定旨在优化资源配置,将近期投资集中于能够以更快速度和规模为患者提供变革性疗法的领域。 寻求外部合作伙伴 推进细胞疗法研究 尽管武田决定退出细胞疗法领域的内部开发工作,公司仍计划通过外部合作伙伴利用其细胞疗法平台技术。武田希望借助合作伙伴推进其现有的研究及临床就绪项目,使这些创新继续造福于患者和医学发展。 目前,武田没有正在开展临床试验的细胞疗法相关产品,但其此前在细胞疗法研究中积累的经验与技术,将继续用于支持其他领域的临床前研究项目。 战略聚焦核心领域 武田决定将研发重点放在更具市场潜力的项目上,包括小分子、生物制剂和抗体药物偶联物(ADC)药物开发。公司希望这些领域的突破性项目,能以更高效率和更大规模满足患者对创新疗法的需求。武田的临床前项目将继续受益于其在细胞疗法研究中获得的宝贵见解,为未来候选治疗药物的开发提供支持。 财务影响:减值损失约580亿日元 武田预计在2025财年第二季度(截至2026年3月31日的财年)将确认约580亿日元的减值损失,主要与其γ-δ T细胞治疗平台相关的无形资产有关。这部分影响已包含在公司于2025年5月8日公布的全年合并预测中,其中涉及约500亿日元的无形资产减值损失。 武田表示,将继续评估任何其他潜在财务影响,并在必要情况下于2025年10月30日第二季度财务业绩报告中反映相关调整。 未来展望:聚焦创新药物开发 武田的决定标志着公司战略调整的关键一步。通过在小分子、生物制剂和ADC药物领域的集中投入,武田希望巩固其在创新医药研发领域的核心竞争力。尽管停止细胞疗法内部开发会带来短期财务上的影响,公司仍对通过合作伙伴推进研发充满信心。未来,武田将继续专注于能够为患者提供突破性疗法的领域,推动关键项目走向临床成果,实现更广泛的全球医疗影响力。2025-10-10
-
 诺华瑞米布替尼片获FDA批准 上市用于治疗慢性自发性荨麻疹(CSU) 2025年10月1日,诺华宣布其BTK抑制剂瑞米布替尼片正式获得美国食品与药品监督管理局(FDA)批准上市,用于治疗在接受H1抗组胺药治疗后仍有症状的成人慢性自发性荨麻疹(CSU)患者。这一口服片剂疗法为CSU患者提供了首个基于BTK通路抑制的治疗选择,同时无需注射与实验室监测,大幅提高了用药的便捷性。 瑞米布替尼片:首个针对BTK的CSU新疗法 瑞米布替尼片是首个获批用于CSU的Bruton酪氨酸激酶(BTK)抑制剂。它通过靶向BTK信号通路,有效阻断肥大细胞中组胺及其他促炎介质的释放。BTK途径在慢性自发性荨麻疹的发病中起到了关键作用,使得瑞米布替尼片成为一种创新疗法。瑞米布替尼片为每日两次口服,无需注射,并能够快速缓解症状,显著提升患者生活质量。 临床试验数据支撑疗效 瑞米布替尼片的获批基于两项III期临床试验(REMIX-1和REMIX-2)的积极结果: 研究设计:试验入组了接受二代H1抗组胺药治疗后仍有症状的CSU患者,评估瑞米布替尼片在控制瘙痒(ISS7)、风团(HSS7)及每周荨麻疹活动度(UAS7)的疗效。 主要疗效指标: 快速起效:瑞米布替尼片在2周内可观察到症状缓解; 12周优效性:与安慰剂相比,瑞米布替尼片在瘙痒和风团症状改善方面显示出显著优势。大约1/3的患者在第12周瘙痒和风团完全消失; 持续控制:接受治疗的患者达到良好控制(UAS7≤6)的比例显著更高。 安全性与耐受性:试验中瑞米布替尼片表现出良好的安全性,常见不良反应(发生率≥3%)包括上呼吸道感染、瘀点和头痛等,无需实验室指标监测。 慢性自发性荨麻疹:一种挑战性慢性疾病 CSU是一种主要由肥大细胞驱动的免疫失调性疾病,其症状包括血管性水肿及难以预测的瘙痒性风团,影响患者的睡眠、工作和心理健康。疾病持续时间通常超过六周,有时需要长达24个月才能确诊。当前抗组胺药作为一线治疗,虽是常用药,但超过一半的患者对其无明显疗效。这些患者可采取注射疗法,但符合条件的患者比例不足20%,并且使用率偏低。 瑞米布替尼片的口服方案为CSU患者提供了一种更简便、更有效的治疗选择,弥补了现有疗法的不足。 全球申请与未来市场布局 除美国外,诺华已向包括欧盟、日本和中国在内的多个国家递交瑞米布替尼片的上市申请,并在中国被授予优先审评资格。诺华计划未来通过这一创新疗法进一步抢占全球CSU治疗市场,为大量抗组胺药无效的患者带来新的治疗希望。 专家展望:为CSU治疗带来变革 诺华创新药物组研究团队表示:“瑞米布替尼片的获批标志着CSU治疗方式的重大突破,尤其是针对既往一线疗法无效的群体。通过靶向BTK通路,瑞米布替尼片快速且持久地缓解患者症状,为CSU治疗设立了新的标准。” 随着全球范围内瑞米布替尼片的推广,未来该药物有望帮助更多CSU患者摆脱困扰,显著改善其生活质量。
诺华瑞米布替尼片获FDA批准 上市用于治疗慢性自发性荨麻疹(CSU) 2025年10月1日,诺华宣布其BTK抑制剂瑞米布替尼片正式获得美国食品与药品监督管理局(FDA)批准上市,用于治疗在接受H1抗组胺药治疗后仍有症状的成人慢性自发性荨麻疹(CSU)患者。这一口服片剂疗法为CSU患者提供了首个基于BTK通路抑制的治疗选择,同时无需注射与实验室监测,大幅提高了用药的便捷性。 瑞米布替尼片:首个针对BTK的CSU新疗法 瑞米布替尼片是首个获批用于CSU的Bruton酪氨酸激酶(BTK)抑制剂。它通过靶向BTK信号通路,有效阻断肥大细胞中组胺及其他促炎介质的释放。BTK途径在慢性自发性荨麻疹的发病中起到了关键作用,使得瑞米布替尼片成为一种创新疗法。瑞米布替尼片为每日两次口服,无需注射,并能够快速缓解症状,显著提升患者生活质量。 临床试验数据支撑疗效 瑞米布替尼片的获批基于两项III期临床试验(REMIX-1和REMIX-2)的积极结果: 研究设计:试验入组了接受二代H1抗组胺药治疗后仍有症状的CSU患者,评估瑞米布替尼片在控制瘙痒(ISS7)、风团(HSS7)及每周荨麻疹活动度(UAS7)的疗效。 主要疗效指标: 快速起效:瑞米布替尼片在2周内可观察到症状缓解; 12周优效性:与安慰剂相比,瑞米布替尼片在瘙痒和风团症状改善方面显示出显著优势。大约1/3的患者在第12周瘙痒和风团完全消失; 持续控制:接受治疗的患者达到良好控制(UAS7≤6)的比例显著更高。 安全性与耐受性:试验中瑞米布替尼片表现出良好的安全性,常见不良反应(发生率≥3%)包括上呼吸道感染、瘀点和头痛等,无需实验室指标监测。 慢性自发性荨麻疹:一种挑战性慢性疾病 CSU是一种主要由肥大细胞驱动的免疫失调性疾病,其症状包括血管性水肿及难以预测的瘙痒性风团,影响患者的睡眠、工作和心理健康。疾病持续时间通常超过六周,有时需要长达24个月才能确诊。当前抗组胺药作为一线治疗,虽是常用药,但超过一半的患者对其无明显疗效。这些患者可采取注射疗法,但符合条件的患者比例不足20%,并且使用率偏低。 瑞米布替尼片的口服方案为CSU患者提供了一种更简便、更有效的治疗选择,弥补了现有疗法的不足。 全球申请与未来市场布局 除美国外,诺华已向包括欧盟、日本和中国在内的多个国家递交瑞米布替尼片的上市申请,并在中国被授予优先审评资格。诺华计划未来通过这一创新疗法进一步抢占全球CSU治疗市场,为大量抗组胺药无效的患者带来新的治疗希望。 专家展望:为CSU治疗带来变革 诺华创新药物组研究团队表示:“瑞米布替尼片的获批标志着CSU治疗方式的重大突破,尤其是针对既往一线疗法无效的群体。通过靶向BTK通路,瑞米布替尼片快速且持久地缓解患者症状,为CSU治疗设立了新的标准。” 随着全球范围内瑞米布替尼片的推广,未来该药物有望帮助更多CSU患者摆脱困扰,显著改善其生活质量。2025-10-10
-
 罗氏联合疗法获FDA批准:阿替利珠单抗与芦比替定突破ES-SCLC维持治疗领域 2025年10月3日,罗氏宣布,美国食品与药物管理局(FDA)正式批准阿替利珠单抗或其皮下制剂联合芦比替定作为广泛期小细胞肺癌(ES-SCLC)成人患者一线治疗后的维持疗法。这是FDA首次批准的针对ES-SCLC维持治疗的组合疗法,为患者提供了新的治疗选择。 突破性联合疗法的研究依据 FDA的批准基于III期IMforte研究,该研究显示阿替利珠单抗联合芦比替定显著提高了ES-SCLC患者的生存期: 总生存期(OS):联合治疗组的中位OS为13.2个月,而阿替利珠单抗单药组为10.6个月(HR=0.73;95%CI:0.57–0.95;p=0.0174); 无进展生存期(PFS):中位PFS联合治疗组为5.4个月,单药组为2.1个月(HR=0.54;95% CI:0.43–0.67;p<0.0001); 疾病控制效果:与阿替利珠单抗单药维持治疗相比,阿替利珠单抗联合芦比替定将疾病进展或死亡风险降低了46%,将死亡风险降低了27%。 诱导治疗后的新希望 广泛期小细胞肺癌是临床上最具侵袭性的肺癌亚型之一,患者在初期治疗后仍面临极高的复发风险,维持治疗成为减缓疾病进展的重要阶段。阿替利珠单抗与芦比替定的联用,不仅为患者提供了一种更有效控制病情的方案,还显著改善了无进展生存期和总生存期,为这一高复发率疾病提供了新的治疗模式。 "诱导治疗后的时期充满不确定性,"耶鲁癌症中心副主任Roy Herbst博士表示,"阿替利珠单抗与芦比替定的组合显著降低了疾病进展风险,为患者和家庭带来了希望,并可能改变我们管理ES-SCLC的方式。" 阿替利珠单抗在ES-SCLC中的持续作用 此次获批是阿替利珠单抗进一步巩固其在ES-SCLC治疗中的位置。早在2019年,基于IMpower133研究,阿替利珠单抗联合化疗被FDA批准用于ES-SCLC一线治疗,是二十年来针对该患者群体的首个新疗法。此次与芦比替定的组合进一步扩大了阿替利珠单抗的临床应用范围。 开启联合疗法新时代 罗氏首席医学官Levi Garraway表示:"阿替利珠单抗与芦比替定组合显示出疾病进展或死亡风险减半的显著优势。我们的目标是通过这样的突破疗法来改善最难治癌症患者的治疗效果。" 罗氏的此次创新是针对难治癌症持续努力的体现,并与Jazz Pharmaceuticals的合作进一步推动了组合治疗的临床进步。 展望未来:改善SCLC患者的治疗前景 广泛期小细胞肺癌(ES-SCLC)长期以来治疗选择有限,此次阿替利珠单抗联合芦比替定获批,提供了一种显著延长生存期的全新治疗方案。通过延缓疾病进展,为患者争取更多的生存时间和生活质量,特别是在复发风险极高的诱导治疗后阶段。 随着阿替利珠单抗在ES-SCLC治疗中的作用持续深化,未来其联合其他治疗方式是否能进一步优化疗效、改善更广泛人群的治疗预后,值得全球临床专家和研究机构的广泛关注。
罗氏联合疗法获FDA批准:阿替利珠单抗与芦比替定突破ES-SCLC维持治疗领域 2025年10月3日,罗氏宣布,美国食品与药物管理局(FDA)正式批准阿替利珠单抗或其皮下制剂联合芦比替定作为广泛期小细胞肺癌(ES-SCLC)成人患者一线治疗后的维持疗法。这是FDA首次批准的针对ES-SCLC维持治疗的组合疗法,为患者提供了新的治疗选择。 突破性联合疗法的研究依据 FDA的批准基于III期IMforte研究,该研究显示阿替利珠单抗联合芦比替定显著提高了ES-SCLC患者的生存期: 总生存期(OS):联合治疗组的中位OS为13.2个月,而阿替利珠单抗单药组为10.6个月(HR=0.73;95%CI:0.57–0.95;p=0.0174); 无进展生存期(PFS):中位PFS联合治疗组为5.4个月,单药组为2.1个月(HR=0.54;95% CI:0.43–0.67;p<0.0001); 疾病控制效果:与阿替利珠单抗单药维持治疗相比,阿替利珠单抗联合芦比替定将疾病进展或死亡风险降低了46%,将死亡风险降低了27%。 诱导治疗后的新希望 广泛期小细胞肺癌是临床上最具侵袭性的肺癌亚型之一,患者在初期治疗后仍面临极高的复发风险,维持治疗成为减缓疾病进展的重要阶段。阿替利珠单抗与芦比替定的联用,不仅为患者提供了一种更有效控制病情的方案,还显著改善了无进展生存期和总生存期,为这一高复发率疾病提供了新的治疗模式。 "诱导治疗后的时期充满不确定性,"耶鲁癌症中心副主任Roy Herbst博士表示,"阿替利珠单抗与芦比替定的组合显著降低了疾病进展风险,为患者和家庭带来了希望,并可能改变我们管理ES-SCLC的方式。" 阿替利珠单抗在ES-SCLC中的持续作用 此次获批是阿替利珠单抗进一步巩固其在ES-SCLC治疗中的位置。早在2019年,基于IMpower133研究,阿替利珠单抗联合化疗被FDA批准用于ES-SCLC一线治疗,是二十年来针对该患者群体的首个新疗法。此次与芦比替定的组合进一步扩大了阿替利珠单抗的临床应用范围。 开启联合疗法新时代 罗氏首席医学官Levi Garraway表示:"阿替利珠单抗与芦比替定组合显示出疾病进展或死亡风险减半的显著优势。我们的目标是通过这样的突破疗法来改善最难治癌症患者的治疗效果。" 罗氏的此次创新是针对难治癌症持续努力的体现,并与Jazz Pharmaceuticals的合作进一步推动了组合治疗的临床进步。 展望未来:改善SCLC患者的治疗前景 广泛期小细胞肺癌(ES-SCLC)长期以来治疗选择有限,此次阿替利珠单抗联合芦比替定获批,提供了一种显著延长生存期的全新治疗方案。通过延缓疾病进展,为患者争取更多的生存时间和生活质量,特别是在复发风险极高的诱导治疗后阶段。 随着阿替利珠单抗在ES-SCLC治疗中的作用持续深化,未来其联合其他治疗方式是否能进一步优化疗效、改善更广泛人群的治疗预后,值得全球临床专家和研究机构的广泛关注。2025-10-09
大家都在看
-
1
荣灿生物获美国专利授权,助力mRNA药物研发新突破
-
2
罗伯医疗获批消化内镜手术机器人,填补国内技术空白
-
3
中国首个IGF-1R抗体药物获批上市,甲状腺眼病治疗迎来新曙光
-
4
广州润尔眼科盐酸依匹斯汀滴眼液获批上市,国内首仿迎来市场竞争新机遇
-
5
孤独症的早期识别与干预:帮助“星星的孩子”走向更好的未来
-
6
重大发现:朊病毒或成胶质母细胞瘤治疗新靶点
-
7
微型心脏起搏器的革新:为新生儿和儿童提供更安全的治疗
-
8
Bright Uro创新发布无导管尿动力学监测系统Glean,获FDA批准
-
9
华东医药司美格鲁肽申报上市,国产GLP-1迎来新突破
-
10
新发现:HDAC2-AS2长非编码RNA在肝细胞癌免疫逃逸中的关键作用
药品推荐
-

替格瑞洛 ticagrelor
适用于急性冠脉综合征患者,如不稳定性心绞痛、非ST段抬高心肌梗死或ST段抬高心肌梗死患者
英国阿斯利康
-

卡麦角林 Cabergoline
治疗帕金森、高催乳素血症及乳腺癌多巴胺D2受体激动剂
美国辉瑞公司(Pfizer Inc.)
-
纳武利尤单抗 Nivolumab
治疗转移性黑色素瘤肾癌肝癌等的免疫药,显著改善生存
美国百时美施贵宝公司(Bristol Myers Squibb)
-
urovaxom Escherichia coli Lysat
用于联合治疗和预防慢性尿路感染,特别是膀胱炎,本品主要用于治疗和预防4岁以上的反复尿路感染
瑞士OM Pharma
-

来那度胺 Lenalidomide
用于多发性骨髓瘤,淋巴瘤中位治疗持续时间延长
印度纳科Natco制药有限公司


