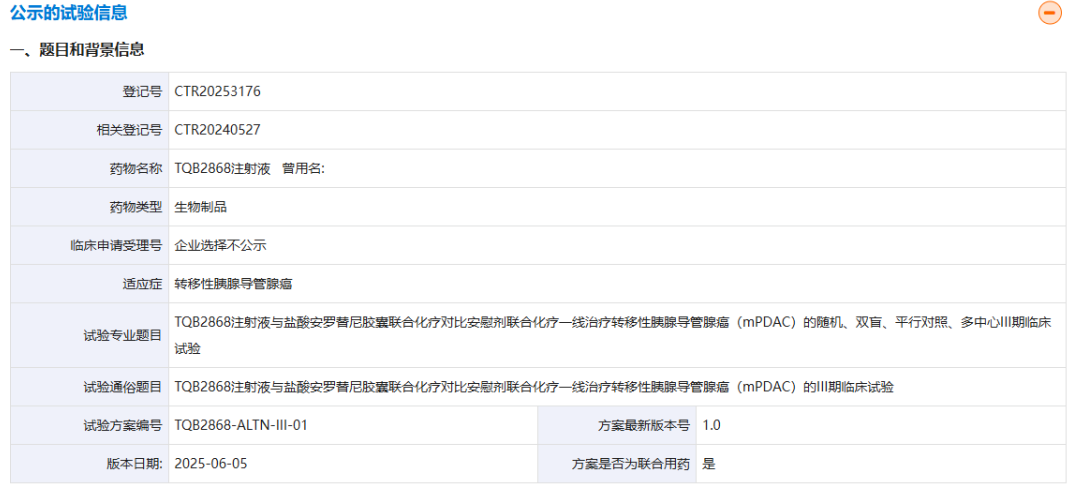
2025年8月12日,药物临床试验登记与信息公示平台显示,正大天晴自主研发的PD-1/TGF-β双功能融合蛋白TQB2868已启动首个III期临床研究。这一进展标志着TQB2868在胰腺癌治疗领域取得了重要突破,并为患者带来了新的治疗希望。
TQB2868:创新的双功能融合蛋白
TQB2868是正大天晴研发的一款靶向PD-1/TGF-β的双功能融合蛋白,不仅能够通过抑制PD-1/PD-L1通路增强T细胞活性,还能有效中和肿瘤微环境中的TGF-β,从而重塑肿瘤微环境,增强抗肿瘤免疫反应。PD-1和TGF-β信号的双重抑制为治疗胰腺癌等恶性肿瘤提供了协同抗癌效果。
根据数据统计,TQB2868已成为全球首个进入III期临床的PD-1/TGF-β双功能融合蛋白药物,这一创举彰显了正大天晴在创新药物领域的领先地位。
III期研究设计:聚焦转移性胰腺导管腺癌(mPDAC)
本次III期研究是一项随机、双盲、多中心、平行对照的临床试验,计划纳入568例转移性胰腺导管腺癌(mPDAC)患者,探讨TQB2868联合安罗替尼和化疗对比安慰剂联合化疗的一线疗效和安全性。试验设计的亮点如下:
治疗方案:TQB2868(300mg,诱导治疗期Q4W,维持治疗期Q3W)联合安罗替尼(8mg或10mg,每日一次)和化疗(吉西他滨+白蛋白结合型紫杉醇)。
主要终点:受试者总生存期(OS)。
试验背景:胰腺癌患者中80%以上为mPDAC,预后极差,中位总生存期(OS)难以突破1年,亟需新型联合疗法推动治疗进展。
II期研究数据:成效显著
在2025年ASCO大会上,正大天晴公布了TQB2868联合安罗替尼及化疗治疗mPDAC的II期临床研究数据,显示该组合疗法实现了积极成果:
共纳入40例患者,其中36例符合疗效评估条件;
疗效数据:ORR达63.9%(23/36),DCR高达100%(36/36);中位PFS与中位OS尚未达到,6个月PFS率和6个月OS率分别为86%和95%;预计OS可超1年;
生物标志物分析:TGF-β1的抑制率超过90%,表明显著的靶向作用;
安全性:3级及以上不良反应的发生率为52.5%,显著低于传统AG化疗方案(68.1%-77%)。
胰腺癌治疗亟需突破
胰腺癌的五年生存率不足10%,因其进展迅速、恶性程度高,被称为“癌中之王”。尤其是占确诊病例80%以上的mPDAC患者,经标准一线化疗治疗后,中位OS难以突破1年,临床亟需新型高效的治疗方案。
TQB2868通过PD-1和TGF-β双重抑制机制,不仅抑制肿瘤生长,还重塑肿瘤微环境,有望突破目前胰腺癌治疗的瓶颈,为患者带来更加显著的生存获益。
临床意义与未来展望
TQB2868的III期研究启动代表了中国企业在多功能融合蛋白药物研发上的创新实力,并为全球胰腺癌治疗探索提供了新选择。如果III期研究成功,将进一步确立TQB2868在胰腺癌领域的治疗地位,并为难治性肿瘤提供更加多功能靶向的标准治疗方案。
未来方向:
III期研究推广应用:加速扩大TQB2868应用范围,探索更多适应症。
联合治疗优化:研究与其他免疫疗法或抗肿瘤靶向药物的联合使用,进一步提升疗效。
机制深入研究:通过标志物研究深化了解TGF-β抑制和免疫微环境重塑的具体作用。
结语
TQB2868作为全球首个进入III期临床的PD-1/TGF-β双功能融合蛋白药物,展现了其卓越的抗肿瘤潜力及临床价值。凭借创新机制和显著疗效,这一药物有望成为胰腺癌等恶性肿瘤领域的新突破,为患者带来更加长久的生存希望和更好的生活质量。