医药资讯
-
 Rybelsus(口服司美格鲁肽)获EMA批准更新标签 展现心血管获益 2025年9月15日,诺和诺德宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已批准更新Rybelsus(口服司美格鲁肽)的标签。这是基于IIIb期SOUL研究的最新结果,反映了其在心血管结局上的显著获益。Rybelsus因此成为首个且唯一在欧盟获批用于2型糖尿病,并被证明具有心血管保护作用的口服胰高血糖素样肽-1受体激动剂(GLP-1 RA)。 心血管健康的里程碑:司美格鲁肽成多领域突破者 “心脏问题是2型糖尿病患者的主要致残和致死原因,因此针对心血管健康的疗法至关重要,”诺和诺德国际运营执行副总裁Emil Kongshøj Larsen表示。他指出,此次标签更新使司美格鲁肽成为唯一同时具有降血糖、减重以及心血管保护功能的口服GLP-1受体激动剂,标志着糖尿病治疗领域的重要进展。 SOUL研究结果:口服司美格鲁肽显著降低心血管事件 IIIb期SOUL研究专门评估了Rybelsus对患有2型糖尿病且伴有动脉粥样硬化性心血管疾病(ASCVD)和/或慢性肾病(CKD)的成年患者心血管结局的影响。 关键数据:与安慰剂相比,口服司美格鲁肽将心血管死亡、心脏病发作及中风的发病率降低了14%。 最新结果:研究进一步显示,Rybelsus显著减少了与严重不良事件相关的住院率,同时其心血管保护效益不受患者体重或体重指数(BMI)的影响。 SOUL研究的详细数据将在2025年欧洲糖尿病研究协会(EASD)年会上公布,为其临床应用提供更多依据。 美国市场:Rybelsus与Wegovy或迎新突破 在美国,FDA预计将在今年晚些时候决定是否为Rybelsus的标签扩展加入心血管适应症。这项决策将帮助司美格鲁肽进一步巩固其在心血管和糖尿病管理领域的领先地位。 此外,诺和诺德也向FDA提交了每日1次25mg口服司美格鲁肽(即口服Wegovy)的上市申请,适用于患有肥胖或超重且伴心血管疾病的成年人。若获批,Wegovy将成为首个用于慢性体重管理的口服GLP-1RA,预计FDA将在今年底作出决定。 司美格鲁肽的广泛潜力与未来方向 司美格鲁肽的应用不仅填补了糖尿病与心血管联动治疗的空白,还为肥胖管理、慢性病预防开辟了新途径。随着SOUL研究和其他临床数据的不断积累,其多领域获益正在逐步被揭示。未来,诺和诺德计划持续拓展司美格鲁肽的适应症,不断满足全球未被满足的医疗需求。 通过此次标签更新,Rybelsus进一步巩固了其在欧盟市场的领先地位,为高心血管风险的糖尿病患者带来了新的希望。
Rybelsus(口服司美格鲁肽)获EMA批准更新标签 展现心血管获益 2025年9月15日,诺和诺德宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已批准更新Rybelsus(口服司美格鲁肽)的标签。这是基于IIIb期SOUL研究的最新结果,反映了其在心血管结局上的显著获益。Rybelsus因此成为首个且唯一在欧盟获批用于2型糖尿病,并被证明具有心血管保护作用的口服胰高血糖素样肽-1受体激动剂(GLP-1 RA)。 心血管健康的里程碑:司美格鲁肽成多领域突破者 “心脏问题是2型糖尿病患者的主要致残和致死原因,因此针对心血管健康的疗法至关重要,”诺和诺德国际运营执行副总裁Emil Kongshøj Larsen表示。他指出,此次标签更新使司美格鲁肽成为唯一同时具有降血糖、减重以及心血管保护功能的口服GLP-1受体激动剂,标志着糖尿病治疗领域的重要进展。 SOUL研究结果:口服司美格鲁肽显著降低心血管事件 IIIb期SOUL研究专门评估了Rybelsus对患有2型糖尿病且伴有动脉粥样硬化性心血管疾病(ASCVD)和/或慢性肾病(CKD)的成年患者心血管结局的影响。 关键数据:与安慰剂相比,口服司美格鲁肽将心血管死亡、心脏病发作及中风的发病率降低了14%。 最新结果:研究进一步显示,Rybelsus显著减少了与严重不良事件相关的住院率,同时其心血管保护效益不受患者体重或体重指数(BMI)的影响。 SOUL研究的详细数据将在2025年欧洲糖尿病研究协会(EASD)年会上公布,为其临床应用提供更多依据。 美国市场:Rybelsus与Wegovy或迎新突破 在美国,FDA预计将在今年晚些时候决定是否为Rybelsus的标签扩展加入心血管适应症。这项决策将帮助司美格鲁肽进一步巩固其在心血管和糖尿病管理领域的领先地位。 此外,诺和诺德也向FDA提交了每日1次25mg口服司美格鲁肽(即口服Wegovy)的上市申请,适用于患有肥胖或超重且伴心血管疾病的成年人。若获批,Wegovy将成为首个用于慢性体重管理的口服GLP-1RA,预计FDA将在今年底作出决定。 司美格鲁肽的广泛潜力与未来方向 司美格鲁肽的应用不仅填补了糖尿病与心血管联动治疗的空白,还为肥胖管理、慢性病预防开辟了新途径。随着SOUL研究和其他临床数据的不断积累,其多领域获益正在逐步被揭示。未来,诺和诺德计划持续拓展司美格鲁肽的适应症,不断满足全球未被满足的医疗需求。 通过此次标签更新,Rybelsus进一步巩固了其在欧盟市场的领先地位,为高心血管风险的糖尿病患者带来了新的希望。2025-09-17
-
 歌礼制药ASC30显示超长效减重维持治疗潜力 2025年9月9日,歌礼制药(Ascletis)公布了其自主研发候选药物ASC30的最新临床数据显示,这是一种超长效皮下(SQ)储库型小分子GLP-1受体(GLP-1R)偏向激动剂,在美国进行的Ib期临床研究(NCT06679959)中,观察到其半衰期达到75天,支持其作为每季度1次给药频率的减重维持治疗。 ASC30简介:创新小分子GLP-1受体激动剂 ASC30是歌礼制药自主研发的全球首个在研小分子GLP-1受体激动剂,既可开发每日1次的口服片剂,也可开发出每月1次或每季度1次的皮下制剂。作为一种新化学实体(NCE),ASC30在美国和全球范围内享有化合物专利保护,专利保护期至2044年(不含专利延期)。ASC30的独特药代动力学特性使其适用于减重治疗和长期体重管理的维持治疗。 临床研究亮点:观察到超长半衰期 在Ib期临床研究中,8例肥胖(BMI≥30kg/m²)受试者单次注射100mg的ASC30 SQ维持制剂后,达到了以下重要结果: 药代特性:平均血药峰浓度(Cmax)的中位时间为17天,表观半衰期(t1/2)为75天。 GI耐受性:胃肠道相关不良事件(如恶心和呕吐)的发生率显著低,分别为0.0%和0.0%,而腹泻和便秘的发生率为12.5%。这表明ASC30 SQ制剂具有良好的胃肠道耐受性。 安全性:未观察到严重不良事件(SAE)或3级及以上的不良事件(AE)。此外,肝酶(如ALT和AST)以及总胆红素(TBL)均未见升高,其他检查如生命体征、心电图和实验室检验均无异常变化。 这些数据表明ASC30 SQ具有良好的安全性和耐受性,其药代动力学特性也能够提供稳定的血药浓度,为其长期体重管理应用奠定了基础。 支持减重和维持治疗的药代动力学优势 歌礼制药7月份已经公布ASC30 SQ治疗制剂适合以每月1次的给药频率进行减重治疗,其药物半衰期在肥胖受试者中为46天。最新数据进一步显示,ASC30 SQ维持制剂的半衰期可达75天,支持以每季度1次的给药频率进行长期体重管理,同时体现了剂量与药代动力学特征的良好线性关系。 下一步研究计划:期待IIa期数据发布 歌礼制药计划在2026年第一季度公布ASC30 SQ减重治疗制剂IIa期研究的顶线数据。这项研究预计将进一步验证该制剂在肥胖治疗中的安全性和有效性,同时为其减重维持疗法的开发提供更多科学依据。那么,ASC30作为一款多功能减重药物,不仅适用于肥胖症的初期治疗,还能为需要长期控制体重的患者提供便捷的治疗方案。 总结:引领减重治疗新风向的突破性药物 ASC30的超长半衰期和良好的安全性为肥胖和体重管理治疗开辟了新方向。凭借每季度给药1次的创新治疗模式,ASC30有望成为肥胖人群为实现减重目标和改善健康状态的重要工具。随着未来临床试验的进一步推进,ASC30或将为全球肥胖管理市场注入更强的动力,为患者带来革命性的治疗选择。
歌礼制药ASC30显示超长效减重维持治疗潜力 2025年9月9日,歌礼制药(Ascletis)公布了其自主研发候选药物ASC30的最新临床数据显示,这是一种超长效皮下(SQ)储库型小分子GLP-1受体(GLP-1R)偏向激动剂,在美国进行的Ib期临床研究(NCT06679959)中,观察到其半衰期达到75天,支持其作为每季度1次给药频率的减重维持治疗。 ASC30简介:创新小分子GLP-1受体激动剂 ASC30是歌礼制药自主研发的全球首个在研小分子GLP-1受体激动剂,既可开发每日1次的口服片剂,也可开发出每月1次或每季度1次的皮下制剂。作为一种新化学实体(NCE),ASC30在美国和全球范围内享有化合物专利保护,专利保护期至2044年(不含专利延期)。ASC30的独特药代动力学特性使其适用于减重治疗和长期体重管理的维持治疗。 临床研究亮点:观察到超长半衰期 在Ib期临床研究中,8例肥胖(BMI≥30kg/m²)受试者单次注射100mg的ASC30 SQ维持制剂后,达到了以下重要结果: 药代特性:平均血药峰浓度(Cmax)的中位时间为17天,表观半衰期(t1/2)为75天。 GI耐受性:胃肠道相关不良事件(如恶心和呕吐)的发生率显著低,分别为0.0%和0.0%,而腹泻和便秘的发生率为12.5%。这表明ASC30 SQ制剂具有良好的胃肠道耐受性。 安全性:未观察到严重不良事件(SAE)或3级及以上的不良事件(AE)。此外,肝酶(如ALT和AST)以及总胆红素(TBL)均未见升高,其他检查如生命体征、心电图和实验室检验均无异常变化。 这些数据表明ASC30 SQ具有良好的安全性和耐受性,其药代动力学特性也能够提供稳定的血药浓度,为其长期体重管理应用奠定了基础。 支持减重和维持治疗的药代动力学优势 歌礼制药7月份已经公布ASC30 SQ治疗制剂适合以每月1次的给药频率进行减重治疗,其药物半衰期在肥胖受试者中为46天。最新数据进一步显示,ASC30 SQ维持制剂的半衰期可达75天,支持以每季度1次的给药频率进行长期体重管理,同时体现了剂量与药代动力学特征的良好线性关系。 下一步研究计划:期待IIa期数据发布 歌礼制药计划在2026年第一季度公布ASC30 SQ减重治疗制剂IIa期研究的顶线数据。这项研究预计将进一步验证该制剂在肥胖治疗中的安全性和有效性,同时为其减重维持疗法的开发提供更多科学依据。那么,ASC30作为一款多功能减重药物,不仅适用于肥胖症的初期治疗,还能为需要长期控制体重的患者提供便捷的治疗方案。 总结:引领减重治疗新风向的突破性药物 ASC30的超长半衰期和良好的安全性为肥胖和体重管理治疗开辟了新方向。凭借每季度给药1次的创新治疗模式,ASC30有望成为肥胖人群为实现减重目标和改善健康状态的重要工具。随着未来临床试验的进一步推进,ASC30或将为全球肥胖管理市场注入更强的动力,为患者带来革命性的治疗选择。2025-09-10
-
 强生INLEXZO膀胱癌治疗系统获FDA批准 可提供无手术选项 2025年9月9日,强生宣布其吉西他滨膀胱内释放系统(INLEXZO,TAR-200)已获FDA批准上市,用于治疗拒绝或不适合根治性膀胱切除术、且对卡介苗(BCG)治疗无反应的成人非肌层浸润性膀胱癌(NMIBC)患者。该系统适用于伴有原位癌(CIS),伴或不伴乳头状肿瘤的病例,为希望保留膀胱的患者提供了一种创新治疗方案。 INLEXZO的创新机制与使用方式 INLEXZO由Taris Biomedical设计,该公司于2019年被强生收购。作为一种膀胱内药物释放系统(iDRS),INLEXZO通过缓释机制将吉西他滨持续释放到膀胱内,从而针对癌症部位提供局部治疗。 系统的植入过程操作简便,可以在门诊环境下进行,仅需几分钟且不需要全麻或进一步监测。这种设计大大减少了患者治疗的复杂性,提高了治疗的可及性。 IIb期临床研究:显著疗效支持FDA批准 此次FDA的批准主要基于SunRISe-1 IIb期临床研究队列2的积极数据。研究是一项单臂、开放标签临床试验,评估了INLEXZO在BCG无反应、不适合或拒绝根治性膀胱切除术的CIS伴或不伴乳头状肿瘤的NMIBC患者中的疗效和安全性。 主要研究终点:完全缓解率(CR)。 次要研究终点:缓解持续时间(DOR)。 研究结果显示,82.4%的患者在治疗后达到了CR,即治疗后未检测到癌症迹象,疗效稳定且持久。其中,51%的患者维持了至少一年的完全缓解状态,显示出优异的长效疗效。 不良反应与安全性 临床试验中,较为常见的不良反应包括尿频、尿路感染、排尿困难、血尿及肌酐升高等(发生率≥15%)。这些不良反应总体上可控,为患者带来了稳定的收益-风险比。 患者的治疗新希望 非肌层浸润性膀胱癌(NMIBC)是一种局限于膀胱内膜的癌症,其护理标准是卡介苗(BCG)治疗。然而,部分患者对BCG无反应,此时建议进行根治性膀胱切除术。但由于手术风险较高且影响患者生活质量,许多老年患者难以接受。 强生执行副总裁Jennifer Taubert表示:“INLEXZO为面临治疗选择有限的膀胱癌患者带来了新的希望。在一个进展缓慢的领域,这一创新治疗方案展示了突破性的影响力。” 展望:膀胱癌治疗的新选择 NMIBC是一种对患者生活质量与健康构成重大威胁的癌症类型,特别是针对BCG无反应患者。目前许多患者因根治性膀胱切除术的高风险而难以得到治疗。因此,INLEXZO的获批为这类患者提供了一种非侵入性的治疗方式,不仅能够显著改善疗效,还可以保留器官,提升患者生活质量。 总之,INLEXZO的成功获批填补了NMIBC无反应患者治疗的空白,为这一困难领域提供了至关重要的新选择。未来,随着这一疗法的推广,更多患者将得益于这一创新的治疗解决方案。
强生INLEXZO膀胱癌治疗系统获FDA批准 可提供无手术选项 2025年9月9日,强生宣布其吉西他滨膀胱内释放系统(INLEXZO,TAR-200)已获FDA批准上市,用于治疗拒绝或不适合根治性膀胱切除术、且对卡介苗(BCG)治疗无反应的成人非肌层浸润性膀胱癌(NMIBC)患者。该系统适用于伴有原位癌(CIS),伴或不伴乳头状肿瘤的病例,为希望保留膀胱的患者提供了一种创新治疗方案。 INLEXZO的创新机制与使用方式 INLEXZO由Taris Biomedical设计,该公司于2019年被强生收购。作为一种膀胱内药物释放系统(iDRS),INLEXZO通过缓释机制将吉西他滨持续释放到膀胱内,从而针对癌症部位提供局部治疗。 系统的植入过程操作简便,可以在门诊环境下进行,仅需几分钟且不需要全麻或进一步监测。这种设计大大减少了患者治疗的复杂性,提高了治疗的可及性。 IIb期临床研究:显著疗效支持FDA批准 此次FDA的批准主要基于SunRISe-1 IIb期临床研究队列2的积极数据。研究是一项单臂、开放标签临床试验,评估了INLEXZO在BCG无反应、不适合或拒绝根治性膀胱切除术的CIS伴或不伴乳头状肿瘤的NMIBC患者中的疗效和安全性。 主要研究终点:完全缓解率(CR)。 次要研究终点:缓解持续时间(DOR)。 研究结果显示,82.4%的患者在治疗后达到了CR,即治疗后未检测到癌症迹象,疗效稳定且持久。其中,51%的患者维持了至少一年的完全缓解状态,显示出优异的长效疗效。 不良反应与安全性 临床试验中,较为常见的不良反应包括尿频、尿路感染、排尿困难、血尿及肌酐升高等(发生率≥15%)。这些不良反应总体上可控,为患者带来了稳定的收益-风险比。 患者的治疗新希望 非肌层浸润性膀胱癌(NMIBC)是一种局限于膀胱内膜的癌症,其护理标准是卡介苗(BCG)治疗。然而,部分患者对BCG无反应,此时建议进行根治性膀胱切除术。但由于手术风险较高且影响患者生活质量,许多老年患者难以接受。 强生执行副总裁Jennifer Taubert表示:“INLEXZO为面临治疗选择有限的膀胱癌患者带来了新的希望。在一个进展缓慢的领域,这一创新治疗方案展示了突破性的影响力。” 展望:膀胱癌治疗的新选择 NMIBC是一种对患者生活质量与健康构成重大威胁的癌症类型,特别是针对BCG无反应患者。目前许多患者因根治性膀胱切除术的高风险而难以得到治疗。因此,INLEXZO的获批为这类患者提供了一种非侵入性的治疗方式,不仅能够显著改善疗效,还可以保留器官,提升患者生活质量。 总之,INLEXZO的成功获批填补了NMIBC无反应患者治疗的空白,为这一困难领域提供了至关重要的新选择。未来,随着这一疗法的推广,更多患者将得益于这一创新的治疗解决方案。2025-09-10
-
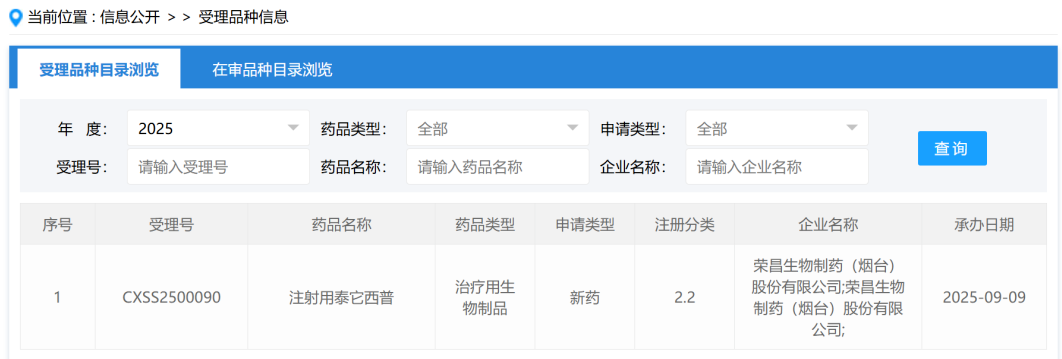 荣昌生物泰它西普递交原发性干燥综合征新适应症申请 9月9日,CDE官网显示,荣昌生物旗下创新药泰它西普已递交新适应症申请,拟用于治疗原发性干燥综合征(pSS)。值得关注的是,这也是全球首个在干燥综合征领域申请上市的生物药物。 泰它西普:双靶点融合创新药 泰它西普由荣昌生物自主研发,是全球首创的重组B淋巴细胞刺激因子(BLyS)/增殖诱导配体(APRIL)双靶点融合蛋白。其机制是同时阻断BLyS与APRIL与B细胞表面受体结合,抑制B细胞异常分化与成熟,从而降低病理性免疫反应,改善疾病症状。 III期临床显示疗效确切 8月13日,泰它西普治疗pSS的III期临床研究达到既定主要终点。试验结果表明,该药能够显著且持续改善患者的干燥症状,并在安全性方面表现良好,为临床治疗提供了新的证据支持。 已布局三大适应症,商业化价值凸显 截至目前,泰它西普已在国内获批三项适应症,分别为系统性红斑狼疮、类风湿性关节炎和重症肌无力。今年6月,荣昌生物与Vor Biopharma达成合作,将泰它西普在大中华区以外的全球开发、生产和商业化权益独家授权给Vor Bio。根据协议,荣昌生物获得1.25亿美元现金及认股权证,总交易金额最高可达42.3亿美元,并有权获得高个位数至双位数比例的销售提成。 干燥综合征:临床需求巨大 原发性干燥综合征是一种慢性炎症性自身免疫疾病,以淋巴细胞浸润和外分泌腺体受损为主要特征。患者常出现口干、眼干等典型症状,部分病例甚至会累及多系统器官。我国pSS的患病率约为0.3%~0.7%,近年来呈逐步上升趋势,尚缺乏有效治疗药物,临床需求亟待满足。 总结 泰它西普作为全球首个在干燥综合征领域提交上市申请的生物药,具有里程碑意义。凭借其独特的双靶点机制与良好的临床数据,未来有望为pSS患者带来全新的治疗选择,并进一步巩固荣昌生物在自身免疫性疾病领域的领先地位。
荣昌生物泰它西普递交原发性干燥综合征新适应症申请 9月9日,CDE官网显示,荣昌生物旗下创新药泰它西普已递交新适应症申请,拟用于治疗原发性干燥综合征(pSS)。值得关注的是,这也是全球首个在干燥综合征领域申请上市的生物药物。 泰它西普:双靶点融合创新药 泰它西普由荣昌生物自主研发,是全球首创的重组B淋巴细胞刺激因子(BLyS)/增殖诱导配体(APRIL)双靶点融合蛋白。其机制是同时阻断BLyS与APRIL与B细胞表面受体结合,抑制B细胞异常分化与成熟,从而降低病理性免疫反应,改善疾病症状。 III期临床显示疗效确切 8月13日,泰它西普治疗pSS的III期临床研究达到既定主要终点。试验结果表明,该药能够显著且持续改善患者的干燥症状,并在安全性方面表现良好,为临床治疗提供了新的证据支持。 已布局三大适应症,商业化价值凸显 截至目前,泰它西普已在国内获批三项适应症,分别为系统性红斑狼疮、类风湿性关节炎和重症肌无力。今年6月,荣昌生物与Vor Biopharma达成合作,将泰它西普在大中华区以外的全球开发、生产和商业化权益独家授权给Vor Bio。根据协议,荣昌生物获得1.25亿美元现金及认股权证,总交易金额最高可达42.3亿美元,并有权获得高个位数至双位数比例的销售提成。 干燥综合征:临床需求巨大 原发性干燥综合征是一种慢性炎症性自身免疫疾病,以淋巴细胞浸润和外分泌腺体受损为主要特征。患者常出现口干、眼干等典型症状,部分病例甚至会累及多系统器官。我国pSS的患病率约为0.3%~0.7%,近年来呈逐步上升趋势,尚缺乏有效治疗药物,临床需求亟待满足。 总结 泰它西普作为全球首个在干燥综合征领域提交上市申请的生物药,具有里程碑意义。凭借其独特的双靶点机制与良好的临床数据,未来有望为pSS患者带来全新的治疗选择,并进一步巩固荣昌生物在自身免疫性疾病领域的领先地位。2025-09-09
-
 君实生物JS005银屑病III期临床试验结果积极 9月7日,君实生物对外宣布,其自主研发的抗IL-17A单克隆抗体JS005在治疗中重度斑块状银屑病的III期注册研究(JS005-005-III-PsO)中取得关键性突破,主要及次要研究终点均显示出统计学显著性和临床获益。公司计划近期向相关监管机构递交上市申请。 JS005作用机制及研发背景 JS005是一款针对IL-17A的特异性抗体药物,能够高亲和力结合IL-17A,并阻断其与受体IL-17RA/IL-17RC的结合,从而抑制下游炎症通路的激活和炎性因子释放。在银屑病、类风湿关节炎、强直性脊柱炎等免疫相关疾病中,IL-17A的异常分泌是疾病发生发展的重要驱动因素。JS005的出现为相关疾病的治疗提供了全新选择。 III期研究设计与结果 该研究是一项多中心、随机、双盲、平行对照临床试验,共纳入747例中重度斑块状银屑病患者。试验设置为JS005(150mg或300mg,皮下注射)对比安慰剂,主要终点包括12周时达到PASI 90(银屑病面积与严重程度指数较基线改善90%及以上)以及静态医师全面评估(sPGA)评分为0或1的患者比例。结果显示,JS005在改善皮损面积和疾病严重程度方面均显著优于安慰剂,同时具有良好的安全性。更多临床数据将于国际学术会议上对外披露。 银屑病的流行病学与危害 银屑病是一种免疫介导的慢性炎症性疾病,具有复发性和系统性特点。全球患病率约为2.0%—3.0%,我国约为0.47%,患者总数超过1.25亿,且呈逐年上升趋势。中重度患者不仅要面对皮肤损害,还可能合并代谢综合征、心血管疾病等系统性风险。此外,抑郁、焦虑甚至自杀倾向在银屑病患者中也更为普遍,对生活质量造成严重影响。 总结 君实生物JS005 III期临床试验的积极结果,为中重度斑块状银屑病患者带来新的治疗希望。随着上市申请的推进,未来有望为广大患者提供更高效、安全的治疗选择,也标志着我国自主研发抗体药物在免疫性疾病治疗领域迈出重要一步。
君实生物JS005银屑病III期临床试验结果积极 9月7日,君实生物对外宣布,其自主研发的抗IL-17A单克隆抗体JS005在治疗中重度斑块状银屑病的III期注册研究(JS005-005-III-PsO)中取得关键性突破,主要及次要研究终点均显示出统计学显著性和临床获益。公司计划近期向相关监管机构递交上市申请。 JS005作用机制及研发背景 JS005是一款针对IL-17A的特异性抗体药物,能够高亲和力结合IL-17A,并阻断其与受体IL-17RA/IL-17RC的结合,从而抑制下游炎症通路的激活和炎性因子释放。在银屑病、类风湿关节炎、强直性脊柱炎等免疫相关疾病中,IL-17A的异常分泌是疾病发生发展的重要驱动因素。JS005的出现为相关疾病的治疗提供了全新选择。 III期研究设计与结果 该研究是一项多中心、随机、双盲、平行对照临床试验,共纳入747例中重度斑块状银屑病患者。试验设置为JS005(150mg或300mg,皮下注射)对比安慰剂,主要终点包括12周时达到PASI 90(银屑病面积与严重程度指数较基线改善90%及以上)以及静态医师全面评估(sPGA)评分为0或1的患者比例。结果显示,JS005在改善皮损面积和疾病严重程度方面均显著优于安慰剂,同时具有良好的安全性。更多临床数据将于国际学术会议上对外披露。 银屑病的流行病学与危害 银屑病是一种免疫介导的慢性炎症性疾病,具有复发性和系统性特点。全球患病率约为2.0%—3.0%,我国约为0.47%,患者总数超过1.25亿,且呈逐年上升趋势。中重度患者不仅要面对皮肤损害,还可能合并代谢综合征、心血管疾病等系统性风险。此外,抑郁、焦虑甚至自杀倾向在银屑病患者中也更为普遍,对生活质量造成严重影响。 总结 君实生物JS005 III期临床试验的积极结果,为中重度斑块状银屑病患者带来新的治疗希望。随着上市申请的推进,未来有望为广大患者提供更高效、安全的治疗选择,也标志着我国自主研发抗体药物在免疫性疾病治疗领域迈出重要一步。2025-09-09
-
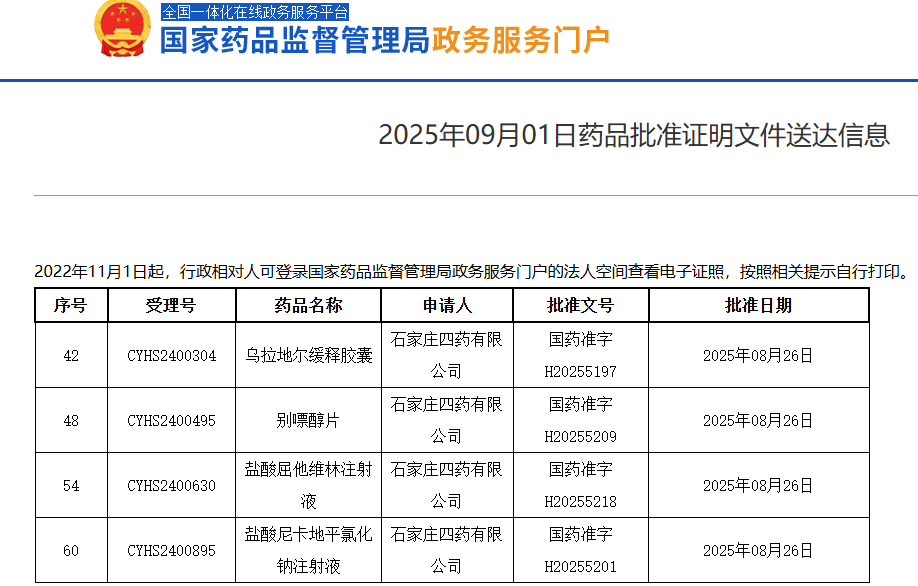 石家庄四药四个产品获批生产 并视同通过一致性评价 近日,根据国家药品监督管理局(NMPA)公示,石家庄四药有限公司的四款药品,包括乌拉地尔缓释胶囊、盐酸尼卡地平氯化钠注射液、别嘌醇片和盐酸屈他维林注射液,获得了生产批准,并视同通过一致性评价。这标志着石四药在高血压及其他相关疾病治疗领域的进一步拓展。 乌拉地尔缓释胶囊打破市场垄断 四款获批产品中,乌拉地尔缓释胶囊尤为引人注目,它成为首个视同通过一致性评价的药品,主要用于高血压的治疗。根据数据,2024年乌拉地尔缓释胶囊的销售额超过4500万元人民币,较去年同比增长了500%。目前,市场上唯一生产该药品的公司为西安远大德天药业,而石家庄四药的获批将打破这一市场垄断局面,为患者提供更多的选择。 四大新品丰富产品线 此次石家庄四药获批的四个药品,不仅在治疗领域上具有重要意义,也为公司的产品线增添了新的成员。随着这些新药的上市,石四药在高血压和其他相关疾病的治疗领域的竞争力将进一步增强,同时也为中国的高血压患者提供了更多的治疗选择,帮助满足日益增长的治疗需求。 总结 石家庄四药此次四个产品的获批,不仅拓宽了其在高血压及相关疾病领域的业务范围,还有效打破了部分药品市场的垄断,为患者提供了更多的治疗选择。这一系列产品的推出,预示着公司在国内外药品市场的影响力将持续增长。
石家庄四药四个产品获批生产 并视同通过一致性评价 近日,根据国家药品监督管理局(NMPA)公示,石家庄四药有限公司的四款药品,包括乌拉地尔缓释胶囊、盐酸尼卡地平氯化钠注射液、别嘌醇片和盐酸屈他维林注射液,获得了生产批准,并视同通过一致性评价。这标志着石四药在高血压及其他相关疾病治疗领域的进一步拓展。 乌拉地尔缓释胶囊打破市场垄断 四款获批产品中,乌拉地尔缓释胶囊尤为引人注目,它成为首个视同通过一致性评价的药品,主要用于高血压的治疗。根据数据,2024年乌拉地尔缓释胶囊的销售额超过4500万元人民币,较去年同比增长了500%。目前,市场上唯一生产该药品的公司为西安远大德天药业,而石家庄四药的获批将打破这一市场垄断局面,为患者提供更多的选择。 四大新品丰富产品线 此次石家庄四药获批的四个药品,不仅在治疗领域上具有重要意义,也为公司的产品线增添了新的成员。随着这些新药的上市,石四药在高血压和其他相关疾病的治疗领域的竞争力将进一步增强,同时也为中国的高血压患者提供了更多的治疗选择,帮助满足日益增长的治疗需求。 总结 石家庄四药此次四个产品的获批,不仅拓宽了其在高血压及相关疾病领域的业务范围,还有效打破了部分药品市场的垄断,为患者提供了更多的治疗选择。这一系列产品的推出,预示着公司在国内外药品市场的影响力将持续增长。2025-09-08
-
 宜诺凯®奥布替尼在新加坡获批治疗复发/难治性边缘区淋巴瘤 近日,诺诚健华(上交所代码:688428;港交所代码:09969)宣布,其自主研发的BTK抑制剂宜诺凯®(奥布替尼)获得新加坡卫生科学局(HSA)批准,用于治疗复发或难治性边缘区淋巴瘤(R/R MZL)成人患者。这是该药物在新加坡获批的第二项适应症,标志着诺诚健华在国际市场布局方面取得新进展。 奥布替尼:高选择性BTK抑制剂 奥布替尼是诺诚健华自主研发的创新型BTK抑制剂,具有高度靶点选择性,可有效减少脱靶相关不良反应,提升患者安全性和疗效。该药物主要面向血液肿瘤及自身免疫疾病领域,旨在为患者提供更精准和耐受性更好的治疗方案。 边缘区淋巴瘤治疗需求迫切 边缘区淋巴瘤(MZL)是一类惰性B细胞非霍奇金淋巴瘤(NHL),主要发病人群为中老年人。随着全球人口老龄化趋势,MZL发病率呈逐年上升态势。虽然一线治疗可使部分患者缓解病情,但复发或难治性患者的有效治疗选择依然有限,亟需创新疗法的加入。 宜诺凯®国内外获批进展 奥布替尼在中国已获批多个适应症,包括既往接受过至少一次治疗的慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)、复发/难治性套细胞淋巴瘤(R/R MCL)和复发/难治性边缘区淋巴瘤(R/R MZL),且三项适应症均已纳入国家医保。今年4月,宜诺凯®又在国内获批用于一线治疗CLL/SLL,为更多患者带来新的治疗希望。此次在新加坡的再度获批,彰显了公司在创新药全球化战略中的持续发力。 总结 奥布替尼在新加坡获批用于复发/难治性边缘区淋巴瘤,不仅满足了患者临床需求,也标志着诺诚健华自主研发药物加速走向国际市场。随着其全球化布局的不断推进,宜诺凯®有望惠及更多血液肿瘤患者,推动中国创新药在国际舞台上的影响力持续提升。
宜诺凯®奥布替尼在新加坡获批治疗复发/难治性边缘区淋巴瘤 近日,诺诚健华(上交所代码:688428;港交所代码:09969)宣布,其自主研发的BTK抑制剂宜诺凯®(奥布替尼)获得新加坡卫生科学局(HSA)批准,用于治疗复发或难治性边缘区淋巴瘤(R/R MZL)成人患者。这是该药物在新加坡获批的第二项适应症,标志着诺诚健华在国际市场布局方面取得新进展。 奥布替尼:高选择性BTK抑制剂 奥布替尼是诺诚健华自主研发的创新型BTK抑制剂,具有高度靶点选择性,可有效减少脱靶相关不良反应,提升患者安全性和疗效。该药物主要面向血液肿瘤及自身免疫疾病领域,旨在为患者提供更精准和耐受性更好的治疗方案。 边缘区淋巴瘤治疗需求迫切 边缘区淋巴瘤(MZL)是一类惰性B细胞非霍奇金淋巴瘤(NHL),主要发病人群为中老年人。随着全球人口老龄化趋势,MZL发病率呈逐年上升态势。虽然一线治疗可使部分患者缓解病情,但复发或难治性患者的有效治疗选择依然有限,亟需创新疗法的加入。 宜诺凯®国内外获批进展 奥布替尼在中国已获批多个适应症,包括既往接受过至少一次治疗的慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)、复发/难治性套细胞淋巴瘤(R/R MCL)和复发/难治性边缘区淋巴瘤(R/R MZL),且三项适应症均已纳入国家医保。今年4月,宜诺凯®又在国内获批用于一线治疗CLL/SLL,为更多患者带来新的治疗希望。此次在新加坡的再度获批,彰显了公司在创新药全球化战略中的持续发力。 总结 奥布替尼在新加坡获批用于复发/难治性边缘区淋巴瘤,不仅满足了患者临床需求,也标志着诺诚健华自主研发药物加速走向国际市场。随着其全球化布局的不断推进,宜诺凯®有望惠及更多血液肿瘤患者,推动中国创新药在国际舞台上的影响力持续提升。2025-09-08
-
 扬子江与大熊制药合作:盐酸菲优拉生片获批上市 2025年9月5日,国家药品监督管理局(NMPA)官方网站发布信息,扬子江药业与大熊制药合作开发的盐酸菲优拉生片(fexuprazan,曾用名:非苏拉赞)已获得正式上市批准。据相关注册临床研究信息推测,该药物主要用于治疗反流性食管炎。 新型药物:钾离子竞争性酸阻滞剂 盐酸菲优拉生片是一种创新的钾离子竞争性酸阻滞剂(P-CAB),属于新一代质子泵抑制剂(PPI)。其作用机制是可逆地抑制分泌胃酸的质子泵,从而有效治疗胃食管反流病,改善患者的症状。 合作背景:海尼药业与大熊制药达成协议 早在2021年3月,扬子江药业的子公司海尼药业与大熊制药就盐酸菲优拉生片达成合作协议。根据协议条款,海尼药业将负责该药物在中国的研发与商业化,支付给大熊制药最高3800亿韩元(约合3.38亿美元)。其中,包括68亿韩元的首付款和136亿韩元的里程碑付款。海尼药业承担该药的临床开发和审批过程,而扬子江药业则负责药品的市场销售。 临床研究:与艾司奥美拉唑对比 盐酸菲优拉生片在中国的III期注册性临床研究(CTR20212441)已经完成。这项研究的目的是评估盐酸菲优拉生片与艾司奥美拉唑镁肠溶片在治疗反流性食管炎方面的有效性、安全性和经济性。该研究的成功为盐酸菲优拉生片的上市奠定了坚实基础。 结语:反流性食管炎治疗新选择 盐酸菲优拉生片的上市为治疗反流性食管炎提供了新的药物选择,尤其是在其优越的疗效和安全性方面,能够为更多患者带来福音。扬子江药业与大熊制药的合作,也将为中国市场带来更多创新治疗方案。
扬子江与大熊制药合作:盐酸菲优拉生片获批上市 2025年9月5日,国家药品监督管理局(NMPA)官方网站发布信息,扬子江药业与大熊制药合作开发的盐酸菲优拉生片(fexuprazan,曾用名:非苏拉赞)已获得正式上市批准。据相关注册临床研究信息推测,该药物主要用于治疗反流性食管炎。 新型药物:钾离子竞争性酸阻滞剂 盐酸菲优拉生片是一种创新的钾离子竞争性酸阻滞剂(P-CAB),属于新一代质子泵抑制剂(PPI)。其作用机制是可逆地抑制分泌胃酸的质子泵,从而有效治疗胃食管反流病,改善患者的症状。 合作背景:海尼药业与大熊制药达成协议 早在2021年3月,扬子江药业的子公司海尼药业与大熊制药就盐酸菲优拉生片达成合作协议。根据协议条款,海尼药业将负责该药物在中国的研发与商业化,支付给大熊制药最高3800亿韩元(约合3.38亿美元)。其中,包括68亿韩元的首付款和136亿韩元的里程碑付款。海尼药业承担该药的临床开发和审批过程,而扬子江药业则负责药品的市场销售。 临床研究:与艾司奥美拉唑对比 盐酸菲优拉生片在中国的III期注册性临床研究(CTR20212441)已经完成。这项研究的目的是评估盐酸菲优拉生片与艾司奥美拉唑镁肠溶片在治疗反流性食管炎方面的有效性、安全性和经济性。该研究的成功为盐酸菲优拉生片的上市奠定了坚实基础。 结语:反流性食管炎治疗新选择 盐酸菲优拉生片的上市为治疗反流性食管炎提供了新的药物选择,尤其是在其优越的疗效和安全性方面,能够为更多患者带来福音。扬子江药业与大熊制药的合作,也将为中国市场带来更多创新治疗方案。2025-09-06
-
 映恩生物HER2 ADC候选药物DB-1303/BNT323 III期临床试验取得突破性进展 9月5日,映恩生物宣布,其HER2抗体药物偶联物(ADC)候选药物DB-1303/BNT323在针对HER2阳性乳腺癌患者的III期临床试验中取得了重大进展。经过独立数据监查委员会(IDMC)评估,与对照组相比,DB-1303/BNT323在全国多中心III期临床试验中达到了由盲态独立中心阅片(BICR)评估的无进展生存期(PFS)主要研究终点。 根据这些中期分析数据,映恩生物计划与中国国家药品监督管理局(NMPA)药品审评中心沟通,启动DB-1303/BNT323的药品上市许可申请(BLA)递交工作。 III期试验简介:比较T-DM1的疗效与安全性 此次III期试验为一项在中国进行的随机、对照、开放标签、多中心的临床研究,旨在评估DB-1303/BNT323与T-DM1(ado-trastuzumab emtansine)在HER2阳性不可切除或转移性乳腺癌患者中的疗效与安全性。这些患者先前均接受过曲妥珠单抗及紫杉烷类药物治疗。 DB-1303/BNT323的设计优势与潜力 DB-1303/BNT323是一种正在临床开发的基于HER2的ADC候选药物,具有以下特点: 稳定的可裂解连接符:能更精准地将药物递送至肿瘤细胞,降低脱靶毒性。 专有拓扑异构酶抑制剂载荷:增强抗肿瘤活性,同时实现“旁观者效应”,能够杀伤周围未标记但同样恶性的肿瘤细胞。 适用广泛患者群体:对HER2高表达及低表达的晚期实体瘤患者均展现了治疗潜力,特别是在乳腺癌、子宫内膜癌、卵巢癌、结直肠癌和食管癌等肿瘤中均显示出客观疗效。 这些设计特点使得DB-1303/BNT323有潜力成为治疗HER2晚期实体瘤患者的新选择。 FDA与NMPA双重突破性疗法认定支持 DB-1303/BNT323已获得以下关键资格认定: 美国FDA的快速通道资格与突破性疗法认定:用于治疗在接受免疫检查点抑制剂治疗时或治疗后出现疾病进展的HER2表达晚期子宫内膜癌患者。 中国NMPA的突破性疗法认定:进一步支持其作为癌症治疗创新药在中国市场开发中的领先地位。 全球临床试验支持与下一步计划 目前,DB-1303/BNT323正处于两项注册性临床试验(包括一项全球试验和一项中国试验)以及另一项潜在全球注册研究的评估阶段。全球范围内,包括美国、中国、澳大利亚等多国患者已参与试验,数据结果进一步验证了其抗肿瘤活性。 映恩生物的合作伙伴BioNTech计划于2025年提交DB-1303/BNT323的药品上市许可申请(BLA),该申请特别针对HER2表达晚期子宫内膜癌的二线或后续治疗,为这一群体的患者带来新的治疗希望。 临床意义与展望 作为一种新的HER2靶向ADC候选药物,DB-1303/BNT323在III期临床试验中的成功,不仅为HER2阳性乳腺癌患者提供了新希望,也展示了其在包括子宫内膜癌、卵巢癌等多种实体瘤中的治疗潜力。其独特的抗肿瘤设计和广泛适应性,使其有望成为HER2表达肿瘤领域的关键创新产品。随着注册申请的逐步推进,这款药物或将在不久的将来进一步丰富HER2阳性或低表达肿瘤患者的治疗选择,为全球患者带来更多福音。
映恩生物HER2 ADC候选药物DB-1303/BNT323 III期临床试验取得突破性进展 9月5日,映恩生物宣布,其HER2抗体药物偶联物(ADC)候选药物DB-1303/BNT323在针对HER2阳性乳腺癌患者的III期临床试验中取得了重大进展。经过独立数据监查委员会(IDMC)评估,与对照组相比,DB-1303/BNT323在全国多中心III期临床试验中达到了由盲态独立中心阅片(BICR)评估的无进展生存期(PFS)主要研究终点。 根据这些中期分析数据,映恩生物计划与中国国家药品监督管理局(NMPA)药品审评中心沟通,启动DB-1303/BNT323的药品上市许可申请(BLA)递交工作。 III期试验简介:比较T-DM1的疗效与安全性 此次III期试验为一项在中国进行的随机、对照、开放标签、多中心的临床研究,旨在评估DB-1303/BNT323与T-DM1(ado-trastuzumab emtansine)在HER2阳性不可切除或转移性乳腺癌患者中的疗效与安全性。这些患者先前均接受过曲妥珠单抗及紫杉烷类药物治疗。 DB-1303/BNT323的设计优势与潜力 DB-1303/BNT323是一种正在临床开发的基于HER2的ADC候选药物,具有以下特点: 稳定的可裂解连接符:能更精准地将药物递送至肿瘤细胞,降低脱靶毒性。 专有拓扑异构酶抑制剂载荷:增强抗肿瘤活性,同时实现“旁观者效应”,能够杀伤周围未标记但同样恶性的肿瘤细胞。 适用广泛患者群体:对HER2高表达及低表达的晚期实体瘤患者均展现了治疗潜力,特别是在乳腺癌、子宫内膜癌、卵巢癌、结直肠癌和食管癌等肿瘤中均显示出客观疗效。 这些设计特点使得DB-1303/BNT323有潜力成为治疗HER2晚期实体瘤患者的新选择。 FDA与NMPA双重突破性疗法认定支持 DB-1303/BNT323已获得以下关键资格认定: 美国FDA的快速通道资格与突破性疗法认定:用于治疗在接受免疫检查点抑制剂治疗时或治疗后出现疾病进展的HER2表达晚期子宫内膜癌患者。 中国NMPA的突破性疗法认定:进一步支持其作为癌症治疗创新药在中国市场开发中的领先地位。 全球临床试验支持与下一步计划 目前,DB-1303/BNT323正处于两项注册性临床试验(包括一项全球试验和一项中国试验)以及另一项潜在全球注册研究的评估阶段。全球范围内,包括美国、中国、澳大利亚等多国患者已参与试验,数据结果进一步验证了其抗肿瘤活性。 映恩生物的合作伙伴BioNTech计划于2025年提交DB-1303/BNT323的药品上市许可申请(BLA),该申请特别针对HER2表达晚期子宫内膜癌的二线或后续治疗,为这一群体的患者带来新的治疗希望。 临床意义与展望 作为一种新的HER2靶向ADC候选药物,DB-1303/BNT323在III期临床试验中的成功,不仅为HER2阳性乳腺癌患者提供了新希望,也展示了其在包括子宫内膜癌、卵巢癌等多种实体瘤中的治疗潜力。其独特的抗肿瘤设计和广泛适应性,使其有望成为HER2表达肿瘤领域的关键创新产品。随着注册申请的逐步推进,这款药物或将在不久的将来进一步丰富HER2阳性或低表达肿瘤患者的治疗选择,为全球患者带来更多福音。2025-09-06
-
 Crunch:革命性蛋白质工具助力癌症与自身免疫疾病治疗 在人体内,吞噬细胞就如同一支高效的“清洁工队伍”,负责处理死亡细胞,维持机体健康。然而,当癌细胞等有害活细胞作乱时,这一自然清理机制往往显得力不从心,无法精准清除这些“捣乱分子”,从而引发一系列健康问题。 Crunch:精准锁定有害细胞 近日,发表在《Nature Biomedical Engineering》的一项研究中,日本京都大学科研团队开发了一种名为Crunch的全新蛋白质工具,带来了癌症与自身免疫性疾病治疗的新希望。Crunch的全称是“Connector for Removal of Unwanted Cell Habitat(连接器:清除不想要的细胞)”,其以高精度的“识别标签”方式,将有害细胞标记为“应该被清除”的目标。 工作原理:精准清除目标细胞 Crunch的核心在于改造名为ProS的蛋白质,ProS原本帮助吞噬细胞识别死亡细胞,而通过基因工程手段,Crunch将ProS的识别机制调整为目标癌细胞或异常免疫细胞。具体过程如下: 标记目标细胞:Crunch识别特定疾病细胞表面的独特蛋白,并与其结合。 激活清理系统:Crunch将目标细胞“连接”至吞噬细胞,令吞噬细胞误认为这些活细胞是需要被清除的对象。 自然清除:吞噬细胞随后吞噬目标细胞,并将其分解,从而达到清除有害细胞的目的。 相比直接杀伤细胞的治疗手段,Crunch通过标记诱导的过程,不仅更加精准,同时大幅减少了对正常细胞的误伤,降低传统治疗带来的副作用。 成功应用于小鼠模型 科研团队将Crunch应用于小鼠模型的实验中,取得了显著成果: 癌症模型:研究人员利用绿色荧光蛋白标记的癌细胞追踪Crunch的工作,发现其显著减少了肿瘤生长。 自身免疫疾病模型:针对系统性红斑狼疮(SLE)模型,Crunch清除了特定异常免疫细胞,并成功减轻了疾病症状。 这些实验结果展现了Crunch在精准清除有害细胞中的高效性和应用潜力。 灵活定制:治疗多种疾病的可能 Crunch具备极强的可定制性,研究人员表示,其靶向传感器可根据不同疾病需求进行调整,并借鉴抗体药物和CAR-T细胞疗法的设计理念。目前,Crunch已展示出广泛的适应潜力,未来或能应用于从癌症到多种自身免疫性疾病的治疗中。 优势与前景展望 简单快捷的给药方式:相比CAR-T细胞治疗的复杂流程,Crunch作为一种蛋白质疗法,只需通过简单注射即可完成治疗。 精准高效:Crunch以标记细胞的方式,将机体的自然清理机制转化为一种治疗方法,从而减少对健康细胞的影响。 广泛适用性:作为一个“治疗平台”,Crunch可灵活应用于多种疾病治疗,未来或将成为医学研究的重要工具。 正如研究者Jun Suzuki教授所言,Crunch的出现极大地拓展了现有蛋白质疗法的使用边界,或能为癌症、红斑狼疮等多种疾病带来治疗新方向。目前,研究团队正致力于提升Crunch的安全性、生产效率及适用性,为其最终应用于临床奠定基础。 结语 Crunch的研发为癌症及自身免疫性疾病患者带来了新的曙光,其精准的清除机制和可扩展性为未来的治疗方式提供了重要启示。在不断完善的基础上,Crunch或将在全球范围内,为治疗难度较高的疾病开启全新篇章。如果临床应用能顺利推进,这一突破性工具将显著改善现有医疗体系中复杂、耗时甚至高风险的治疗过程,给患者带来更安全、更便捷的治疗选择。
Crunch:革命性蛋白质工具助力癌症与自身免疫疾病治疗 在人体内,吞噬细胞就如同一支高效的“清洁工队伍”,负责处理死亡细胞,维持机体健康。然而,当癌细胞等有害活细胞作乱时,这一自然清理机制往往显得力不从心,无法精准清除这些“捣乱分子”,从而引发一系列健康问题。 Crunch:精准锁定有害细胞 近日,发表在《Nature Biomedical Engineering》的一项研究中,日本京都大学科研团队开发了一种名为Crunch的全新蛋白质工具,带来了癌症与自身免疫性疾病治疗的新希望。Crunch的全称是“Connector for Removal of Unwanted Cell Habitat(连接器:清除不想要的细胞)”,其以高精度的“识别标签”方式,将有害细胞标记为“应该被清除”的目标。 工作原理:精准清除目标细胞 Crunch的核心在于改造名为ProS的蛋白质,ProS原本帮助吞噬细胞识别死亡细胞,而通过基因工程手段,Crunch将ProS的识别机制调整为目标癌细胞或异常免疫细胞。具体过程如下: 标记目标细胞:Crunch识别特定疾病细胞表面的独特蛋白,并与其结合。 激活清理系统:Crunch将目标细胞“连接”至吞噬细胞,令吞噬细胞误认为这些活细胞是需要被清除的对象。 自然清除:吞噬细胞随后吞噬目标细胞,并将其分解,从而达到清除有害细胞的目的。 相比直接杀伤细胞的治疗手段,Crunch通过标记诱导的过程,不仅更加精准,同时大幅减少了对正常细胞的误伤,降低传统治疗带来的副作用。 成功应用于小鼠模型 科研团队将Crunch应用于小鼠模型的实验中,取得了显著成果: 癌症模型:研究人员利用绿色荧光蛋白标记的癌细胞追踪Crunch的工作,发现其显著减少了肿瘤生长。 自身免疫疾病模型:针对系统性红斑狼疮(SLE)模型,Crunch清除了特定异常免疫细胞,并成功减轻了疾病症状。 这些实验结果展现了Crunch在精准清除有害细胞中的高效性和应用潜力。 灵活定制:治疗多种疾病的可能 Crunch具备极强的可定制性,研究人员表示,其靶向传感器可根据不同疾病需求进行调整,并借鉴抗体药物和CAR-T细胞疗法的设计理念。目前,Crunch已展示出广泛的适应潜力,未来或能应用于从癌症到多种自身免疫性疾病的治疗中。 优势与前景展望 简单快捷的给药方式:相比CAR-T细胞治疗的复杂流程,Crunch作为一种蛋白质疗法,只需通过简单注射即可完成治疗。 精准高效:Crunch以标记细胞的方式,将机体的自然清理机制转化为一种治疗方法,从而减少对健康细胞的影响。 广泛适用性:作为一个“治疗平台”,Crunch可灵活应用于多种疾病治疗,未来或将成为医学研究的重要工具。 正如研究者Jun Suzuki教授所言,Crunch的出现极大地拓展了现有蛋白质疗法的使用边界,或能为癌症、红斑狼疮等多种疾病带来治疗新方向。目前,研究团队正致力于提升Crunch的安全性、生产效率及适用性,为其最终应用于临床奠定基础。 结语 Crunch的研发为癌症及自身免疫性疾病患者带来了新的曙光,其精准的清除机制和可扩展性为未来的治疗方式提供了重要启示。在不断完善的基础上,Crunch或将在全球范围内,为治疗难度较高的疾病开启全新篇章。如果临床应用能顺利推进,这一突破性工具将显著改善现有医疗体系中复杂、耗时甚至高风险的治疗过程,给患者带来更安全、更便捷的治疗选择。2025-09-05
大家都在看
-
1
荣灿生物获美国专利授权,助力mRNA药物研发新突破
-
2
罗伯医疗获批消化内镜手术机器人,填补国内技术空白
-
3
中国首个IGF-1R抗体药物获批上市,甲状腺眼病治疗迎来新曙光
-
4
广州润尔眼科盐酸依匹斯汀滴眼液获批上市,国内首仿迎来市场竞争新机遇
-
5
孤独症的早期识别与干预:帮助“星星的孩子”走向更好的未来
-
6
重大发现:朊病毒或成胶质母细胞瘤治疗新靶点
-
7
微型心脏起搏器的革新:为新生儿和儿童提供更安全的治疗
-
8
Bright Uro创新发布无导管尿动力学监测系统Glean,获FDA批准
-
9
华东医药司美格鲁肽申报上市,国产GLP-1迎来新突破
-
10
新发现:HDAC2-AS2长非编码RNA在肝细胞癌免疫逃逸中的关键作用
药品推荐
-

左旋炔诺酮 levonorgestrel
适用于口服避孕
美国辉瑞公司(Pfizer Inc.)
-

卡麦角林 Cabergoline
治疗帕金森、高催乳素血症及乳腺癌多巴胺D2受体激动剂
美国辉瑞公司(Pfizer Inc.)
-
纳武利尤单抗 Nivolumab
治疗转移性黑色素瘤肾癌肝癌等的免疫药,显著改善生存
美国百时美施贵宝公司(Bristol Myers Squibb)
-
urovaxom Escherichia coli Lysat
用于联合治疗和预防慢性尿路感染,特别是膀胱炎,本品主要用于治疗和预防4岁以上的反复尿路感染
瑞士OM Pharma
-

来那度胺 Lenalidomide
用于多发性骨髓瘤,淋巴瘤中位治疗持续时间延长
印度纳科Natco制药有限公司


