医药资讯
-
 大鹏药品递交新药申请,寻求加速批准zipalertinib用于EGFR ex20ins突变非小细胞肺癌治疗 大鹏药品工业株式会社(Taiho Pharmaceutical)、Taiho Oncology和Cullinan Therapeutics近日宣布,已向美国FDA递交滚动的新药申请(NDA),请求对其在研小分子药物zipalertinib进行加速批准,治疗携带EGFR第20外显子插入突变(ex20ins)的局部晚期或转移性非小细胞肺癌(NSCLC)患者,且患者此前已经接受过含铂化疗。此次NDA申请主要基于REZILIENT1临床试验的积极数据。 Zipalertinib:靶向EGFR ex20ins突变的新型抑制剂 Zipalertinib是一种口服小分子药物,专门靶向携带EGFR外显子20插入突变的EGFR变体。与其他EGFR抑制剂不同,zipalertinib能够专门抑制携带此特定突变的EGFR变体,同时避免对野生型EGFR的抑制。这使得它成为治疗携带EGFR ex20ins突变的非小细胞肺癌患者的理想药物。 REZILIENT1试验:积极数据支持NDA递交 该NDA递交的主要依据是REZILIENT1试验的正面结果,这是一项针对已经接受过前期治疗的、携带EGFR ex20ins突变的非小细胞肺癌患者的zipalertinib单药1/2期临床试验。该试验结果显示zipalertinib在改善患者的肿瘤控制和生存期方面表现出积极的治疗效果,进一步支持了其作为一种潜在治疗方案的临床价值。 Zipalertinib的突破性疗法认定 Zipalertinib曾获得FDA授予的突破性疗法认定(Breakthrough Therapy Designation)。这一认证旨在加速创新药物的研发与审批,特别是针对严重疾病且具有显著临床优势的治疗药物。zipalertinib的加速批准申请如果顺利通过,预计将为携带EGFR ex20ins突变的晚期非小细胞肺癌患者提供一条新的治疗途径。 此次NDA申请的递交标志着zipalertinib进入了加速审批的关键阶段,如果获得批准,zipalertinib有望为特定基因亚型的非小细胞肺癌患者带来新的治疗选择,进一步推动EGFR突变相关肺癌治疗的创新发展。
大鹏药品递交新药申请,寻求加速批准zipalertinib用于EGFR ex20ins突变非小细胞肺癌治疗 大鹏药品工业株式会社(Taiho Pharmaceutical)、Taiho Oncology和Cullinan Therapeutics近日宣布,已向美国FDA递交滚动的新药申请(NDA),请求对其在研小分子药物zipalertinib进行加速批准,治疗携带EGFR第20外显子插入突变(ex20ins)的局部晚期或转移性非小细胞肺癌(NSCLC)患者,且患者此前已经接受过含铂化疗。此次NDA申请主要基于REZILIENT1临床试验的积极数据。 Zipalertinib:靶向EGFR ex20ins突变的新型抑制剂 Zipalertinib是一种口服小分子药物,专门靶向携带EGFR外显子20插入突变的EGFR变体。与其他EGFR抑制剂不同,zipalertinib能够专门抑制携带此特定突变的EGFR变体,同时避免对野生型EGFR的抑制。这使得它成为治疗携带EGFR ex20ins突变的非小细胞肺癌患者的理想药物。 REZILIENT1试验:积极数据支持NDA递交 该NDA递交的主要依据是REZILIENT1试验的正面结果,这是一项针对已经接受过前期治疗的、携带EGFR ex20ins突变的非小细胞肺癌患者的zipalertinib单药1/2期临床试验。该试验结果显示zipalertinib在改善患者的肿瘤控制和生存期方面表现出积极的治疗效果,进一步支持了其作为一种潜在治疗方案的临床价值。 Zipalertinib的突破性疗法认定 Zipalertinib曾获得FDA授予的突破性疗法认定(Breakthrough Therapy Designation)。这一认证旨在加速创新药物的研发与审批,特别是针对严重疾病且具有显著临床优势的治疗药物。zipalertinib的加速批准申请如果顺利通过,预计将为携带EGFR ex20ins突变的晚期非小细胞肺癌患者提供一条新的治疗途径。 此次NDA申请的递交标志着zipalertinib进入了加速审批的关键阶段,如果获得批准,zipalertinib有望为特定基因亚型的非小细胞肺癌患者带来新的治疗选择,进一步推动EGFR突变相关肺癌治疗的创新发展。2025-11-28
-
 诺诚健华Soficitinib(ICP-332)治疗结节性痒疹II期临床试验启动 诺诚健华(香港联交所代码:09969;上交所代码:688428)近日宣布,其自主研发的新型TYK2抑制剂Soficitinib(ICP-332)已完成结节性痒疹全球II期临床试验的首例患者给药。这一进展标志着公司在皮肤科领域的持续创新与布局。 Soficitinib:一种高效、高选择性的TYK2抑制剂 Soficitinib是诺诚健华研发的一款口服TYK2抑制剂,具有高效且高选择性的特点。该药物已在多个自身免疫性疾病领域展开研发,特别是在T细胞介导的疾病中具有重要的应用潜力。目前,Soficitinib的适应症广泛,包括特应性皮炎、白癜风、结节性痒疹和荨麻疹等,皮肤科市场成为其开发的核心方向之一。 TYK2的作用机制与结节性痒疹的治疗 TYK2是Janus激酶(JAK)家族中的一员,参与了JAK-STAT信号通路的调控,并在许多炎症性疾病的发病机制中起着重要作用。Soficitinib通过抑制TYK2的活性,能够有效阻断与瘙痒和炎症相关的细胞因子信号通路,特别是IL-4、IL-13和IL-31等因子,从而减轻神经性瘙痒反应和皮肤炎症,改善结节性痒疹的症状。 结节性痒疹的临床挑战 结节性痒疹是一种慢性皮肤病,患者常常受到剧烈瘙痒和皮肤结节的困扰,极大地影响了患者的日常生活和心理健康。现有的治疗方法难以全面缓解症状,因此,开发新的治疗方案对患者而言至关重要。 未来展望 Soficitinib作为一种新型TYK2抑制剂,凭借其对结节性痒疹的潜在疗效,给广大患者带来了新的治疗希望。随着II期临床试验的推进,若取得积极结果,Soficitinib有望成为治疗结节性痒疹和其他自身免疫性疾病的重要药物,进一步巩固诺诚健华在免疫治疗领域的竞争力。
诺诚健华Soficitinib(ICP-332)治疗结节性痒疹II期临床试验启动 诺诚健华(香港联交所代码:09969;上交所代码:688428)近日宣布,其自主研发的新型TYK2抑制剂Soficitinib(ICP-332)已完成结节性痒疹全球II期临床试验的首例患者给药。这一进展标志着公司在皮肤科领域的持续创新与布局。 Soficitinib:一种高效、高选择性的TYK2抑制剂 Soficitinib是诺诚健华研发的一款口服TYK2抑制剂,具有高效且高选择性的特点。该药物已在多个自身免疫性疾病领域展开研发,特别是在T细胞介导的疾病中具有重要的应用潜力。目前,Soficitinib的适应症广泛,包括特应性皮炎、白癜风、结节性痒疹和荨麻疹等,皮肤科市场成为其开发的核心方向之一。 TYK2的作用机制与结节性痒疹的治疗 TYK2是Janus激酶(JAK)家族中的一员,参与了JAK-STAT信号通路的调控,并在许多炎症性疾病的发病机制中起着重要作用。Soficitinib通过抑制TYK2的活性,能够有效阻断与瘙痒和炎症相关的细胞因子信号通路,特别是IL-4、IL-13和IL-31等因子,从而减轻神经性瘙痒反应和皮肤炎症,改善结节性痒疹的症状。 结节性痒疹的临床挑战 结节性痒疹是一种慢性皮肤病,患者常常受到剧烈瘙痒和皮肤结节的困扰,极大地影响了患者的日常生活和心理健康。现有的治疗方法难以全面缓解症状,因此,开发新的治疗方案对患者而言至关重要。 未来展望 Soficitinib作为一种新型TYK2抑制剂,凭借其对结节性痒疹的潜在疗效,给广大患者带来了新的治疗希望。随着II期临床试验的推进,若取得积极结果,Soficitinib有望成为治疗结节性痒疹和其他自身免疫性疾病的重要药物,进一步巩固诺诚健华在免疫治疗领域的竞争力。2025-11-28
-
 齐鲁制药布地奈德肠溶胶囊上市申请获CDE受理 2025年11月25日,据国家药品监督管理局药品审评中心(CDE)官网信息显示,齐鲁制药提交的4类仿制药——布地奈德肠溶胶囊的上市申请已正式获受理。这意味着国内布地奈德口服制剂的市场格局有望迎来新的竞争者。 国内首个布地奈德肠溶胶囊仿制药申报受理 根据药品数据库资料,目前国内市场上布地奈德相关产品主要以吸入剂型为主,包括吸入用混悬液、鼻喷雾剂、吸入气雾剂和吸入粉雾剂等。相比之下,布地奈德肠溶胶囊剂型尚属空白,此次齐鲁制药的申报,或将填补该领域在国内的空缺。 全球首款IgA肾病对因治疗药物 布地奈德肠溶胶囊(英文商品名:Tarpeyo / Nefecon,中文商品名:耐赋康)由瑞典制药公司 Calliditas Therapeutics 研发,是全球首个用于IgA肾病的对因治疗药物。该药通过靶向小肠回肠末端的免疫反应,调节免疫系统,从而改善IgA肾病患者的肾功能。 国内批准与市场前景 2023年11月,布地奈德肠溶胶囊在中国正式获批上市,成为我国首个也是唯一获批IgA肾病适应症的治疗药物。此次齐鲁制药提交的仿制药申请,若顺利获批,将有助于提高该药物的可及性,并推动国内IgA肾病治疗进入更加普惠的阶段。 总结:国产替代加速临床可及 齐鲁制药的仿制药受理标志着国内企业正加速布局IgA肾病领域。随着布地奈德肠溶胶囊仿制药的推进,未来有望打破进口药物在该细分领域的垄断,为更多患者带来更具性价比的治疗选择,也将推动我国在罕见病及慢性肾病治疗领域的技术创新与产业发展。
齐鲁制药布地奈德肠溶胶囊上市申请获CDE受理 2025年11月25日,据国家药品监督管理局药品审评中心(CDE)官网信息显示,齐鲁制药提交的4类仿制药——布地奈德肠溶胶囊的上市申请已正式获受理。这意味着国内布地奈德口服制剂的市场格局有望迎来新的竞争者。 国内首个布地奈德肠溶胶囊仿制药申报受理 根据药品数据库资料,目前国内市场上布地奈德相关产品主要以吸入剂型为主,包括吸入用混悬液、鼻喷雾剂、吸入气雾剂和吸入粉雾剂等。相比之下,布地奈德肠溶胶囊剂型尚属空白,此次齐鲁制药的申报,或将填补该领域在国内的空缺。 全球首款IgA肾病对因治疗药物 布地奈德肠溶胶囊(英文商品名:Tarpeyo / Nefecon,中文商品名:耐赋康)由瑞典制药公司 Calliditas Therapeutics 研发,是全球首个用于IgA肾病的对因治疗药物。该药通过靶向小肠回肠末端的免疫反应,调节免疫系统,从而改善IgA肾病患者的肾功能。 国内批准与市场前景 2023年11月,布地奈德肠溶胶囊在中国正式获批上市,成为我国首个也是唯一获批IgA肾病适应症的治疗药物。此次齐鲁制药提交的仿制药申请,若顺利获批,将有助于提高该药物的可及性,并推动国内IgA肾病治疗进入更加普惠的阶段。 总结:国产替代加速临床可及 齐鲁制药的仿制药受理标志着国内企业正加速布局IgA肾病领域。随着布地奈德肠溶胶囊仿制药的推进,未来有望打破进口药物在该细分领域的垄断,为更多患者带来更具性价比的治疗选择,也将推动我国在罕见病及慢性肾病治疗领域的技术创新与产业发展。2025-11-27
-
 硕腾公司推出全新抗体疗法Lenivia®,缓解犬类骨关节炎疼痛 2025年11月26日,硕腾公司宣布其创新产品Lenivia®(izenivetmab)已获得欧盟委员会的批准,可在欧盟市场正式上市。这款新型疗法专为缓解犬类骨关节炎(OA)引起的疼痛而设计。 Lenivia的独特疗效 Lenivia®是一种独特的抗体疗法,通过其特有的神经生长因子(NGF)结合特性,只需要一次注射,就能在三个月内显著减轻犬类的骨关节炎疼痛。神经生长因子(NGF)被公认为与疼痛和炎症密切相关的关键介质,因此,Lenivia的创新机制能够有效针对这一点,从而为犬类提供长效缓解。 基于十年科学研究的成果 Lenivia®的研发历时十年,依托坚实的科学研究基础。通过这一时期的持续努力,硕腾公司成功开发出了这一能够精准靶向神经生长因子的疗法。 临床研究证实疗效与安全性 在一项为期九个月的实地临床研究中,Lenivia®展示了显著的疗效和安全性。研究表明,接受Lenivia治疗的犬只在注射后活动能力明显增强,且疼痛减轻,显示出治疗效果的持久性和高效性。 未来展望 随着Lenivia®的获批上市,硕腾公司将进一步推进犬类骨关节炎治疗领域的创新,为更多犬只带来福音。此项治疗的成功也标志着兽医学领域新的进展,尤其在缓解骨关节炎带来的痛苦方面,为宠物健康护理开辟了新篇章。
硕腾公司推出全新抗体疗法Lenivia®,缓解犬类骨关节炎疼痛 2025年11月26日,硕腾公司宣布其创新产品Lenivia®(izenivetmab)已获得欧盟委员会的批准,可在欧盟市场正式上市。这款新型疗法专为缓解犬类骨关节炎(OA)引起的疼痛而设计。 Lenivia的独特疗效 Lenivia®是一种独特的抗体疗法,通过其特有的神经生长因子(NGF)结合特性,只需要一次注射,就能在三个月内显著减轻犬类的骨关节炎疼痛。神经生长因子(NGF)被公认为与疼痛和炎症密切相关的关键介质,因此,Lenivia的创新机制能够有效针对这一点,从而为犬类提供长效缓解。 基于十年科学研究的成果 Lenivia®的研发历时十年,依托坚实的科学研究基础。通过这一时期的持续努力,硕腾公司成功开发出了这一能够精准靶向神经生长因子的疗法。 临床研究证实疗效与安全性 在一项为期九个月的实地临床研究中,Lenivia®展示了显著的疗效和安全性。研究表明,接受Lenivia治疗的犬只在注射后活动能力明显增强,且疼痛减轻,显示出治疗效果的持久性和高效性。 未来展望 随着Lenivia®的获批上市,硕腾公司将进一步推进犬类骨关节炎治疗领域的创新,为更多犬只带来福音。此项治疗的成功也标志着兽医学领域新的进展,尤其在缓解骨关节炎带来的痛苦方面,为宠物健康护理开辟了新篇章。2025-11-27
-
 FDA批准基因疗法Itvisma上市:为SMA治疗带来新突破 近日,美国食品药品监督管理局(FDA)正式批准Itvisma上市,用于治疗携带SMN1基因突变的2岁及以上脊髓性肌萎缩症(SMA)儿童及成人患者。这标志着SMA基因治疗领域迎来了新的里程碑,也为这一罕见遗传病患者群体带来了更为便捷、持久的治疗新方案。 AAV载体驱动的精准基因替代疗法 Itvisma由诺华公司旗下AveXis生物技术公司开发,是一款基于腺相关病毒(AAV9)载体的基因替代疗法。 该药采用鞘内注射(intrathecal injection)方式给药,属于一次性固定剂量治疗方案,无需根据患者年龄或体重调整剂量,大大简化了临床操作流程。 Itvisma的核心机制是将正常的SMN1基因通过AAV9载体导入患者神经系统中,从而在体内重新合成功能性SMN1蛋白。这一蛋白是维持运动神经元健康和肌肉功能的关键分子。疗法实施后,患者的运动神经元功能得到修复,进而改善肌肉力量与运动能力。 与传统药物相比的显著优势 在SMA治疗领域,传统疗法主要包括Spinraza(努西那生钠)和Evrysdi(利司扑兰)。然而,这两款药物都需要长期、重复给药: Spinraza需每4个月进行一次腰椎注射; Evrysdi则为每日口服,需要患者持续服用。 相比之下,Itvisma的一次性基因替代机制可实现长期疗效,减少患者反复就诊和用药负担,显著提升治疗依从性和生活质量。 改写SMA治疗格局 脊髓性肌萎缩症(SMA)是一种由SMN1基因缺陷引起的罕见神经退行性疾病,主要影响脊髓中的运动神经元,导致肌肉无力、萎缩,严重者甚至危及生命。 Itvisma的获批,为这类患者提供了更具根本性的治疗选择,有望延缓疾病进展,恢复部分运动功能。 业内专家指出,Itvisma的上市标志着SMA治疗从“症状控制”迈向“基因修复”阶段,不仅延续了诺华在罕见病基因疗法领域的领先优势,也为更多神经系统疾病的基因治疗提供了可借鉴的路径。 未来展望:让更多患者受益 随着Itvisma在美国获批上市,诺华计划进一步推动该疗法的国际注册与临床应用拓展,为全球SMA患者带来新的希望。 未来,随着基因治疗成本的逐步降低和技术的成熟,像Itvisma这样的一次性根治型药物,有望成为罕见病治疗的重要方向。 总结 Itvisma的成功上市不仅是基因治疗领域的重要突破,更意味着SMA患者将有机会摆脱长期注射和每日服药的束缚。 这款创新疗法以AAV9为载体,从根源修复基因缺陷,为全球罕见病治疗打开了新局面,也预示着基因药物进入精准化、可持续发展的新时代。
FDA批准基因疗法Itvisma上市:为SMA治疗带来新突破 近日,美国食品药品监督管理局(FDA)正式批准Itvisma上市,用于治疗携带SMN1基因突变的2岁及以上脊髓性肌萎缩症(SMA)儿童及成人患者。这标志着SMA基因治疗领域迎来了新的里程碑,也为这一罕见遗传病患者群体带来了更为便捷、持久的治疗新方案。 AAV载体驱动的精准基因替代疗法 Itvisma由诺华公司旗下AveXis生物技术公司开发,是一款基于腺相关病毒(AAV9)载体的基因替代疗法。 该药采用鞘内注射(intrathecal injection)方式给药,属于一次性固定剂量治疗方案,无需根据患者年龄或体重调整剂量,大大简化了临床操作流程。 Itvisma的核心机制是将正常的SMN1基因通过AAV9载体导入患者神经系统中,从而在体内重新合成功能性SMN1蛋白。这一蛋白是维持运动神经元健康和肌肉功能的关键分子。疗法实施后,患者的运动神经元功能得到修复,进而改善肌肉力量与运动能力。 与传统药物相比的显著优势 在SMA治疗领域,传统疗法主要包括Spinraza(努西那生钠)和Evrysdi(利司扑兰)。然而,这两款药物都需要长期、重复给药: Spinraza需每4个月进行一次腰椎注射; Evrysdi则为每日口服,需要患者持续服用。 相比之下,Itvisma的一次性基因替代机制可实现长期疗效,减少患者反复就诊和用药负担,显著提升治疗依从性和生活质量。 改写SMA治疗格局 脊髓性肌萎缩症(SMA)是一种由SMN1基因缺陷引起的罕见神经退行性疾病,主要影响脊髓中的运动神经元,导致肌肉无力、萎缩,严重者甚至危及生命。 Itvisma的获批,为这类患者提供了更具根本性的治疗选择,有望延缓疾病进展,恢复部分运动功能。 业内专家指出,Itvisma的上市标志着SMA治疗从“症状控制”迈向“基因修复”阶段,不仅延续了诺华在罕见病基因疗法领域的领先优势,也为更多神经系统疾病的基因治疗提供了可借鉴的路径。 未来展望:让更多患者受益 随着Itvisma在美国获批上市,诺华计划进一步推动该疗法的国际注册与临床应用拓展,为全球SMA患者带来新的希望。 未来,随着基因治疗成本的逐步降低和技术的成熟,像Itvisma这样的一次性根治型药物,有望成为罕见病治疗的重要方向。 总结 Itvisma的成功上市不仅是基因治疗领域的重要突破,更意味着SMA患者将有机会摆脱长期注射和每日服药的束缚。 这款创新疗法以AAV9为载体,从根源修复基因缺陷,为全球罕见病治疗打开了新局面,也预示着基因药物进入精准化、可持续发展的新时代。2025-11-26
-
 诺华瑞米布替尼片获批上市:开启慢性荨麻疹精准治疗新时代 近日,全球制药巨头诺华公司(Novartis)宣布,其自主研发的创新药物瑞普多®(瑞米布替尼片)正式获得中国国家药品监督管理局(NMPA)批准,用于H1抗组胺药疗效不足的成人慢性自发性荨麻疹(CSU)患者。这一突破性进展,标志着中国在慢性荨麻疹领域迎来了口服小分子靶向治疗的新纪元。 慢性自发性荨麻疹治疗迎来新选择 慢性自发性荨麻疹是一种以反复瘙痒性风团或皮肤肿胀为特征的过敏性疾病,病程常持续数月至数年,严重影响患者生活质量。据流行病学数据,中国约有超过1000万名成人患者长期受到CSU困扰。 长期以来,治疗主要依赖H1抗组胺药物,但约有一半以上患者对其反应不足,缺乏有效的治疗方案。瑞米布替尼片的获批,正是在这一治疗瓶颈下带来全新希望。 瑞米布替尼:首个国产获批的BTK口服小分子药物 瑞米布替尼是一种选择性布鲁顿酪氨酸激酶(BTK)抑制剂,通过精准调控免疫信号通路,能够阻断B细胞及肥大细胞介导的过敏反应,从而减轻皮肤瘙痒、风团等症状。 与传统治疗相比,瑞米布替尼具有以下优势: 口服方便,服药依从性高; 起效迅速,可在短时间内明显缓解症状; 机制创新,通过调节免疫信号根源改善病情。 此次获批,使BTK靶点在自身免疫及过敏性疾病治疗领域实现了重要延展,也进一步验证了诺华在免疫调控药物研发领域的领先实力。 改变治疗格局:精准靶向疗法加速落地 瑞米布替尼片的上市,不仅意味着CSU患者在传统抗组胺药无效后拥有了全新的治疗路径,也代表着BTK抑制剂在过敏性疾病中的临床应用正式落地。 该药物的临床研究显示,瑞米布替尼能显著降低CSU症状评分,改善患者睡眠质量和日常生活功能,同时安全性表现良好,耐受性高。 这一突破性成果将推动慢性荨麻疹治疗从“对症控制”迈向“免疫调节与病因靶向”的新阶段,为中国CSU临床管理带来里程碑式的进步。 展望未来:为更多过敏性疾病带来希望 诺华方面表示,瑞米布替尼的成功上市是其在免疫性疾病精准治疗战略中的关键一步。未来,公司计划继续拓展BTK抑制剂在哮喘、特应性皮炎、过敏性鼻炎等疾病中的应用研究,探索更多免疫系统相关疾病的治疗可能。 结语 随着瑞米布替尼片在中国获批上市,慢性自发性荨麻疹患者将迎来真正意义上的靶向化、精准化治疗时代。这不仅填补了国内在口服BTK抑制剂治疗CSU领域的空白,也为全球抗过敏与免疫疾病研究注入了新的动力。未来,随着更多创新药物的落地,CSU等慢性免疫性疾病的治疗格局或将被彻底改写。
诺华瑞米布替尼片获批上市:开启慢性荨麻疹精准治疗新时代 近日,全球制药巨头诺华公司(Novartis)宣布,其自主研发的创新药物瑞普多®(瑞米布替尼片)正式获得中国国家药品监督管理局(NMPA)批准,用于H1抗组胺药疗效不足的成人慢性自发性荨麻疹(CSU)患者。这一突破性进展,标志着中国在慢性荨麻疹领域迎来了口服小分子靶向治疗的新纪元。 慢性自发性荨麻疹治疗迎来新选择 慢性自发性荨麻疹是一种以反复瘙痒性风团或皮肤肿胀为特征的过敏性疾病,病程常持续数月至数年,严重影响患者生活质量。据流行病学数据,中国约有超过1000万名成人患者长期受到CSU困扰。 长期以来,治疗主要依赖H1抗组胺药物,但约有一半以上患者对其反应不足,缺乏有效的治疗方案。瑞米布替尼片的获批,正是在这一治疗瓶颈下带来全新希望。 瑞米布替尼:首个国产获批的BTK口服小分子药物 瑞米布替尼是一种选择性布鲁顿酪氨酸激酶(BTK)抑制剂,通过精准调控免疫信号通路,能够阻断B细胞及肥大细胞介导的过敏反应,从而减轻皮肤瘙痒、风团等症状。 与传统治疗相比,瑞米布替尼具有以下优势: 口服方便,服药依从性高; 起效迅速,可在短时间内明显缓解症状; 机制创新,通过调节免疫信号根源改善病情。 此次获批,使BTK靶点在自身免疫及过敏性疾病治疗领域实现了重要延展,也进一步验证了诺华在免疫调控药物研发领域的领先实力。 改变治疗格局:精准靶向疗法加速落地 瑞米布替尼片的上市,不仅意味着CSU患者在传统抗组胺药无效后拥有了全新的治疗路径,也代表着BTK抑制剂在过敏性疾病中的临床应用正式落地。 该药物的临床研究显示,瑞米布替尼能显著降低CSU症状评分,改善患者睡眠质量和日常生活功能,同时安全性表现良好,耐受性高。 这一突破性成果将推动慢性荨麻疹治疗从“对症控制”迈向“免疫调节与病因靶向”的新阶段,为中国CSU临床管理带来里程碑式的进步。 展望未来:为更多过敏性疾病带来希望 诺华方面表示,瑞米布替尼的成功上市是其在免疫性疾病精准治疗战略中的关键一步。未来,公司计划继续拓展BTK抑制剂在哮喘、特应性皮炎、过敏性鼻炎等疾病中的应用研究,探索更多免疫系统相关疾病的治疗可能。 结语 随着瑞米布替尼片在中国获批上市,慢性自发性荨麻疹患者将迎来真正意义上的靶向化、精准化治疗时代。这不仅填补了国内在口服BTK抑制剂治疗CSU领域的空白,也为全球抗过敏与免疫疾病研究注入了新的动力。未来,随着更多创新药物的落地,CSU等慢性免疫性疾病的治疗格局或将被彻底改写。2025-11-26
-
 绿叶制药新药LY03017获FDA临床许可:有望改善阿尔茨海默与帕金森精神症状 近日,绿叶制药集团宣布,其自主研发的创新药物 LY03017 获得美国食品药品监督管理局(FDA)临床试验许可。这款药物是一种 新一代5-羟色胺2A型受体(5-HT2AR)反向激动剂 与 5-羟色胺2C型受体(5-HT2CR)拮抗剂 的复合分子,拟用于治疗 阿尔茨海默病精神病性障碍(ADP)、帕金森病精神病性障碍(PDP) 以及 精神分裂症阴性症状(NSS)。 FDA批准跳过SAD阶段,直接进入多剂量试验 根据绿叶制药披露,FDA已正式豁免LY03017在Ⅰ期临床中的 单次给药剂量递增(SAD)试验 环节,允许药物直接进入 多次给药剂量递增(MAD)阶段 及后续临床研究。这一决定意味着该药物在安全性及早期药代方面具备较强信心基础,有望加速进入关键性临床阶段。 填补多领域未满足的治疗空白 目前,全球仅有一款药物获得FDA批准用于治疗PDP,但尚未在中国上市;而针对ADP的治疗,至今无任何药物在全球范围获批。至于NSS领域,虽然部分药物对症状有一定缓解作用,但总体疗效有限,患者的临床需求仍然亟待满足。 LY03017的研发旨在同时覆盖这三大中枢神经系统疾病,为相关患者群体提供新的治疗选择。 独特作用机制:调控多巴胺平衡 LY03017通过 5-HT2AR反向激动 与 5-HT2CR拮抗 双重机制,能够在不同脑区实现精准的神经递质调节。其机制主要包括: 抑制腹侧纹状体多巴胺释放,减轻幻觉与妄想等精神病性症状; 促进前额叶皮层多巴胺释放,从而改善认知与情绪功能; 综合调节多巴胺平衡,有助于缓解精神分裂症的阴性症状。 这种双靶点机制不仅能够缓解ADP和PDP中的幻觉与妄想症状,还可能改善患者的社交退缩、情感淡漠等负性表现。 前期研究表现优异 临床前研究结果表明,LY03017在 体内外药效、脑组织分布及心脏安全性 等方面均显著优于同类在研及已上市药物。尤其在动物模型中,LY03017显示出 更稳定的神经保护作用与更低的不良反应风险,为后续人体试验提供了坚实的数据支持。 展望:为中枢神经药物创新注入新动力 绿叶制药表示,LY03017的成功获批不仅意味着公司在中枢神经系统疾病领域的又一重大突破,也为全球阿尔茨海默病与帕金森病相关精神障碍的精准治疗提供了新方向。随着临床试验的推进,LY03017有望成为首批同时兼顾ADP、PDP及NSS治疗潜力的创新药物,为患者带来更长远的康复希望。
绿叶制药新药LY03017获FDA临床许可:有望改善阿尔茨海默与帕金森精神症状 近日,绿叶制药集团宣布,其自主研发的创新药物 LY03017 获得美国食品药品监督管理局(FDA)临床试验许可。这款药物是一种 新一代5-羟色胺2A型受体(5-HT2AR)反向激动剂 与 5-羟色胺2C型受体(5-HT2CR)拮抗剂 的复合分子,拟用于治疗 阿尔茨海默病精神病性障碍(ADP)、帕金森病精神病性障碍(PDP) 以及 精神分裂症阴性症状(NSS)。 FDA批准跳过SAD阶段,直接进入多剂量试验 根据绿叶制药披露,FDA已正式豁免LY03017在Ⅰ期临床中的 单次给药剂量递增(SAD)试验 环节,允许药物直接进入 多次给药剂量递增(MAD)阶段 及后续临床研究。这一决定意味着该药物在安全性及早期药代方面具备较强信心基础,有望加速进入关键性临床阶段。 填补多领域未满足的治疗空白 目前,全球仅有一款药物获得FDA批准用于治疗PDP,但尚未在中国上市;而针对ADP的治疗,至今无任何药物在全球范围获批。至于NSS领域,虽然部分药物对症状有一定缓解作用,但总体疗效有限,患者的临床需求仍然亟待满足。 LY03017的研发旨在同时覆盖这三大中枢神经系统疾病,为相关患者群体提供新的治疗选择。 独特作用机制:调控多巴胺平衡 LY03017通过 5-HT2AR反向激动 与 5-HT2CR拮抗 双重机制,能够在不同脑区实现精准的神经递质调节。其机制主要包括: 抑制腹侧纹状体多巴胺释放,减轻幻觉与妄想等精神病性症状; 促进前额叶皮层多巴胺释放,从而改善认知与情绪功能; 综合调节多巴胺平衡,有助于缓解精神分裂症的阴性症状。 这种双靶点机制不仅能够缓解ADP和PDP中的幻觉与妄想症状,还可能改善患者的社交退缩、情感淡漠等负性表现。 前期研究表现优异 临床前研究结果表明,LY03017在 体内外药效、脑组织分布及心脏安全性 等方面均显著优于同类在研及已上市药物。尤其在动物模型中,LY03017显示出 更稳定的神经保护作用与更低的不良反应风险,为后续人体试验提供了坚实的数据支持。 展望:为中枢神经药物创新注入新动力 绿叶制药表示,LY03017的成功获批不仅意味着公司在中枢神经系统疾病领域的又一重大突破,也为全球阿尔茨海默病与帕金森病相关精神障碍的精准治疗提供了新方向。随着临床试验的推进,LY03017有望成为首批同时兼顾ADP、PDP及NSS治疗潜力的创新药物,为患者带来更长远的康复希望。2025-11-25
-
 全球首个可治疗广泛年龄段 SMA 患者的基因疗法获批:Zolgensma 再获 FDA 认可 当地时间 11 月 24 日,制药巨头诺华(Novartis)宣布,美国食品药品监督管理局(FDA)正式批准 Onasemnogene abeparvovec 鞘内注射液(商品名 Zolgensma,代号 OAV101 注射液,Itvisma®),用于治疗两岁及以上、经确诊携带 SMN1 基因突变 的脊髓性肌萎缩症(SMA)患者,包括儿童、青少年与成人。 这意味着,Zolgensma 已成为首个覆盖广泛年龄层患者的基因替代疗法,在 SMA 治疗领域再度实现重大突破。 一次性疗法:根源性修复 SMN1 基因缺陷 诺华在新闻稿中指出,Zolgensma 的最大特点是 通过一次性给药即可针对 SMA 的根本遗传缺陷。该疗法不依赖患者的体重或年龄调整剂量,而是以固定剂量方式,直接将健康的 SMN1 基因 引入患者体内,促进 SMN 蛋白 的持续表达,从而改善肌肉功能,减缓或阻止疾病的进展。 Zolgensma 通过 腺相关病毒载体(AAV9) 将修复基因输送至运动神经元,仅需一次注射即可实现长期治疗效果,显著降低了传统治疗中需要长期给药的负担。 从婴儿到成人:SMA 治疗的时代跨越 Zolgensma 最初于 2019 年 5 月获 FDA 批准上市,用于 两岁以下 I 型 SMA 患者。此次扩展适应症的批准,标志着该疗法正式进入儿童及成人治疗领域,意味着更多患者将有机会通过基因替代疗法受益。 研究显示,接受 Zolgensma 治疗的 SMA 患者在运动能力方面有明显改善,部分重症患者甚至恢复了自主呼吸与行走能力,这在以往的治疗模式中几乎不可想象。 研发投入巨大:单剂价格高达 210 万美元 Zolgensma 的研发历程堪称漫长且昂贵。诺华在 2018 年以 87 亿美元 收购 AveXis 公司后,持续投入研发与生产,累计投资超过 94 亿美元(约人民币 669 亿元)。 高昂的研发成本也使得该药成为全球最昂贵药物之一。目前 Zolgensma 的单剂售价约为 210 万美元(约人民币 1495 万元),位列「全球十大最贵药物」第九位。尽管价格高昂,但其“一次性治愈”理念仍让众多罕见病家庭将其视为“希望之药”。 未来展望:基因疗法版图持续扩大 Zolgensma 的再次获批,不仅为 SMA 患者带来新的治疗希望,也为 基因疗法的临床应用与商业化 提供了重要里程碑。诺华表示,将继续在全球范围内推动相关临床研究,进一步评估其在不同患者群体中的长期疗效与安全性。 业内专家认为,此次 FDA 批准意味着基因替代疗法正从婴幼儿扩展至更广泛的人群,或将开启神经退行性疾病精准治疗的新纪元。
全球首个可治疗广泛年龄段 SMA 患者的基因疗法获批:Zolgensma 再获 FDA 认可 当地时间 11 月 24 日,制药巨头诺华(Novartis)宣布,美国食品药品监督管理局(FDA)正式批准 Onasemnogene abeparvovec 鞘内注射液(商品名 Zolgensma,代号 OAV101 注射液,Itvisma®),用于治疗两岁及以上、经确诊携带 SMN1 基因突变 的脊髓性肌萎缩症(SMA)患者,包括儿童、青少年与成人。 这意味着,Zolgensma 已成为首个覆盖广泛年龄层患者的基因替代疗法,在 SMA 治疗领域再度实现重大突破。 一次性疗法:根源性修复 SMN1 基因缺陷 诺华在新闻稿中指出,Zolgensma 的最大特点是 通过一次性给药即可针对 SMA 的根本遗传缺陷。该疗法不依赖患者的体重或年龄调整剂量,而是以固定剂量方式,直接将健康的 SMN1 基因 引入患者体内,促进 SMN 蛋白 的持续表达,从而改善肌肉功能,减缓或阻止疾病的进展。 Zolgensma 通过 腺相关病毒载体(AAV9) 将修复基因输送至运动神经元,仅需一次注射即可实现长期治疗效果,显著降低了传统治疗中需要长期给药的负担。 从婴儿到成人:SMA 治疗的时代跨越 Zolgensma 最初于 2019 年 5 月获 FDA 批准上市,用于 两岁以下 I 型 SMA 患者。此次扩展适应症的批准,标志着该疗法正式进入儿童及成人治疗领域,意味着更多患者将有机会通过基因替代疗法受益。 研究显示,接受 Zolgensma 治疗的 SMA 患者在运动能力方面有明显改善,部分重症患者甚至恢复了自主呼吸与行走能力,这在以往的治疗模式中几乎不可想象。 研发投入巨大:单剂价格高达 210 万美元 Zolgensma 的研发历程堪称漫长且昂贵。诺华在 2018 年以 87 亿美元 收购 AveXis 公司后,持续投入研发与生产,累计投资超过 94 亿美元(约人民币 669 亿元)。 高昂的研发成本也使得该药成为全球最昂贵药物之一。目前 Zolgensma 的单剂售价约为 210 万美元(约人民币 1495 万元),位列「全球十大最贵药物」第九位。尽管价格高昂,但其“一次性治愈”理念仍让众多罕见病家庭将其视为“希望之药”。 未来展望:基因疗法版图持续扩大 Zolgensma 的再次获批,不仅为 SMA 患者带来新的治疗希望,也为 基因疗法的临床应用与商业化 提供了重要里程碑。诺华表示,将继续在全球范围内推动相关临床研究,进一步评估其在不同患者群体中的长期疗效与安全性。 业内专家认为,此次 FDA 批准意味着基因替代疗法正从婴幼儿扩展至更广泛的人群,或将开启神经退行性疾病精准治疗的新纪元。2025-11-25
-
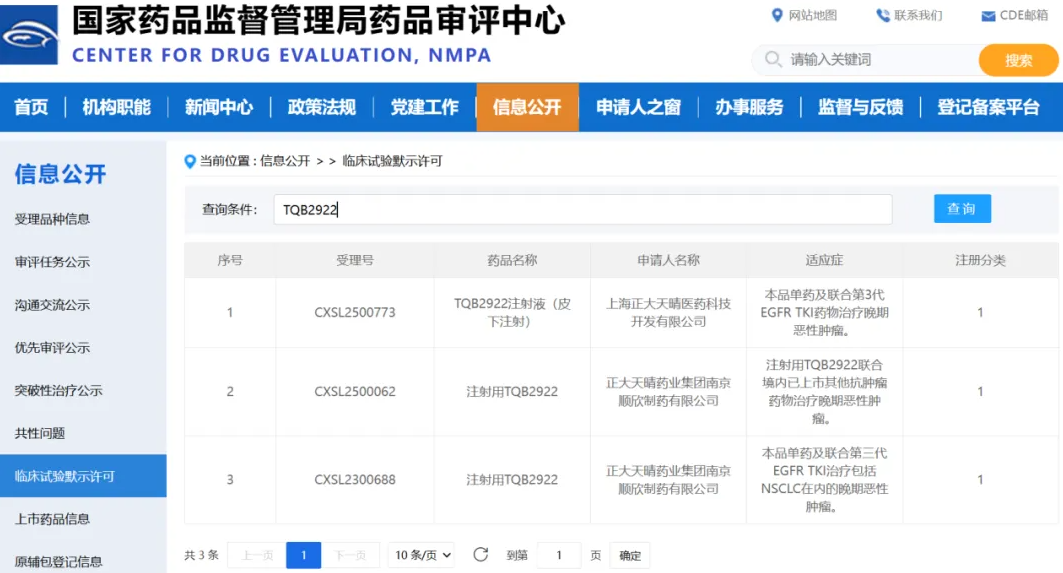 正大天晴创新药TQB2922皮下注射剂获临床默示许可 11月17日,国家药品监督管理局药品审评中心(CDE)发布最新公示,由上海正大天晴申报的1类创新药TQB2922皮下注射剂型正式获得临床试验默示许可。该药将用于单药或联合第三代EGFR TKI药物治疗晚期恶性肿瘤,为肿瘤患者提供新的治疗选择。 此前,TQB2922的静脉注射剂型已在国内获得临床试验批准,而此次皮下注射版本的问世,标志着正大天晴首次依托自研平台技术,成功突破了大分子药物皮下给药体积受限的行业难题。 双靶点机制:精准阻断EGFR/c-Met信号通路 TQB2922是一款自主研发的EGFR/c-Met双特异性抗体,通过同时结合肿瘤细胞表皮生长因子受体(EGFR)与间质表皮转化因子受体(c-Met),能够有效阻断两条信号通路的异常激活,抑制肿瘤细胞的增殖、侵袭与转移。 除了直接阻断信号传导外,TQB2922还能激活机体免疫系统,通过自然杀伤细胞(NK细胞)与巨噬细胞介导的抗体依赖性细胞毒作用(ADCC)与抗体依赖性细胞吞噬作用(ADCP),实现对肿瘤细胞的双重打击。 动物实验显著验证抗肿瘤活性 非临床实验数据表明,在EGFR 20外显子插入突变的非小细胞肺癌(NSCLC)移植瘤模型以及神经胶质瘤小鼠模型中,TQB2922均表现出显著的肿瘤生长抑制效果。 研究结果显示,TQB2922可有效延缓肿瘤进展,为后续临床研究奠定了坚实基础。 多瘤种布局,探索联合治疗新潜力 目前,TQB2922静脉注射剂型的I期临床研究正在稳步推进,预计将在2026年国际学术会议上公布初步结果。与此同时,正大天晴正在积极探索TQB2922与多种抗肿瘤药物的联合应用,包括非小细胞肺癌、结直肠癌及头颈鳞癌等多个肿瘤类型。 此次皮下注射剂型的获批,不仅为临床用药带来更高的便利性,也为未来居家治疗与慢病管理提供了可能。 打造自主创新新样本 TQB2922的连续突破,体现了正大天晴在抗体药物工程化设计与创新剂型开发方面的深厚实力。随着临床研究的深入推进,该药有望成为中国本土原研双特异性抗体药物的代表性成果,为多种难治性肿瘤患者带来新的希望。
正大天晴创新药TQB2922皮下注射剂获临床默示许可 11月17日,国家药品监督管理局药品审评中心(CDE)发布最新公示,由上海正大天晴申报的1类创新药TQB2922皮下注射剂型正式获得临床试验默示许可。该药将用于单药或联合第三代EGFR TKI药物治疗晚期恶性肿瘤,为肿瘤患者提供新的治疗选择。 此前,TQB2922的静脉注射剂型已在国内获得临床试验批准,而此次皮下注射版本的问世,标志着正大天晴首次依托自研平台技术,成功突破了大分子药物皮下给药体积受限的行业难题。 双靶点机制:精准阻断EGFR/c-Met信号通路 TQB2922是一款自主研发的EGFR/c-Met双特异性抗体,通过同时结合肿瘤细胞表皮生长因子受体(EGFR)与间质表皮转化因子受体(c-Met),能够有效阻断两条信号通路的异常激活,抑制肿瘤细胞的增殖、侵袭与转移。 除了直接阻断信号传导外,TQB2922还能激活机体免疫系统,通过自然杀伤细胞(NK细胞)与巨噬细胞介导的抗体依赖性细胞毒作用(ADCC)与抗体依赖性细胞吞噬作用(ADCP),实现对肿瘤细胞的双重打击。 动物实验显著验证抗肿瘤活性 非临床实验数据表明,在EGFR 20外显子插入突变的非小细胞肺癌(NSCLC)移植瘤模型以及神经胶质瘤小鼠模型中,TQB2922均表现出显著的肿瘤生长抑制效果。 研究结果显示,TQB2922可有效延缓肿瘤进展,为后续临床研究奠定了坚实基础。 多瘤种布局,探索联合治疗新潜力 目前,TQB2922静脉注射剂型的I期临床研究正在稳步推进,预计将在2026年国际学术会议上公布初步结果。与此同时,正大天晴正在积极探索TQB2922与多种抗肿瘤药物的联合应用,包括非小细胞肺癌、结直肠癌及头颈鳞癌等多个肿瘤类型。 此次皮下注射剂型的获批,不仅为临床用药带来更高的便利性,也为未来居家治疗与慢病管理提供了可能。 打造自主创新新样本 TQB2922的连续突破,体现了正大天晴在抗体药物工程化设计与创新剂型开发方面的深厚实力。随着临床研究的深入推进,该药有望成为中国本土原研双特异性抗体药物的代表性成果,为多种难治性肿瘤患者带来新的希望。2025-11-24
-
 国药集团武汉生物所两款儿童疫苗研发迎来重大突破 Sabin株灭活脊灰疫苗正式获批上市 近日,国药集团中国生物武汉生物制品研究所在儿童疫苗自主创新领域再传捷报。其研发的Sabin株脊髓灰质炎灭活疫苗(Vero细胞)已获国家药品监督管理局批准上市(批准文号:国药准字S20250060),标志着我国在脊灰防控和疫苗产业化方面实现新的跨越。 该疫苗依托武汉生物所成熟的哺乳动物细胞大规模培养技术平台,采用微载体高密度培养与高精度纯化工艺制备而成,具有抗原纯度高、杂质残留低、生产批次稳定等优势。 该产品可有效预防由脊髓灰质炎病毒Ⅰ型、Ⅱ型及Ⅲ型引起的脊髓灰质炎(俗称“小儿麻痹症”),为我国儿童群体提供更加安全可靠的免疫防护屏障。 “一针防五病” 五联疫苗获批临床 与此同时,另一项由武汉生物所研发的吸附无细胞百白破灭活脊灰及b型流感嗜血杆菌(结合)联合疫苗(简称“五联疫苗”)也正式获得国家药监局临床试验批准(受理号:CXSL2500756)。这意味着我国在多联疫苗自主研发领域再添重要进展。 该五联疫苗通过精准抗原纯化、抗原比例优化与佐剂协同设计实现多种成分高效融合,适用于2月龄及以上婴幼儿接种。其防护范围覆盖白喉、破伤风、百日咳、脊髓灰质炎及b型流感嗜血杆菌等五种传染病。 传统免疫接种程序需要11次注射加2次口服,而五联疫苗可简化为4次注射即可完成全程免疫。这一改进不仅能显著减少婴幼儿的接种次数和痛苦,还能提升家长的接种意愿,优化基层医疗资源配置。凭借“一针多防”的显著优势,该疫苗有望进一步提高我国儿童疫苗接种率与覆盖率。 推动高端疫苗自主化,强化公共健康防线 武汉生物所负责人表示,此次两款产品的成功推进,充分展现了我国在重大传染病防控和高端多联疫苗自主创新领域的研发实力。未来,研究所将继续加强核心技术攻关,推动更多具有自主知识产权的疫苗产品进入临床与市场应用阶段,为全球公共卫生事业贡献“中国方案”。
国药集团武汉生物所两款儿童疫苗研发迎来重大突破 Sabin株灭活脊灰疫苗正式获批上市 近日,国药集团中国生物武汉生物制品研究所在儿童疫苗自主创新领域再传捷报。其研发的Sabin株脊髓灰质炎灭活疫苗(Vero细胞)已获国家药品监督管理局批准上市(批准文号:国药准字S20250060),标志着我国在脊灰防控和疫苗产业化方面实现新的跨越。 该疫苗依托武汉生物所成熟的哺乳动物细胞大规模培养技术平台,采用微载体高密度培养与高精度纯化工艺制备而成,具有抗原纯度高、杂质残留低、生产批次稳定等优势。 该产品可有效预防由脊髓灰质炎病毒Ⅰ型、Ⅱ型及Ⅲ型引起的脊髓灰质炎(俗称“小儿麻痹症”),为我国儿童群体提供更加安全可靠的免疫防护屏障。 “一针防五病” 五联疫苗获批临床 与此同时,另一项由武汉生物所研发的吸附无细胞百白破灭活脊灰及b型流感嗜血杆菌(结合)联合疫苗(简称“五联疫苗”)也正式获得国家药监局临床试验批准(受理号:CXSL2500756)。这意味着我国在多联疫苗自主研发领域再添重要进展。 该五联疫苗通过精准抗原纯化、抗原比例优化与佐剂协同设计实现多种成分高效融合,适用于2月龄及以上婴幼儿接种。其防护范围覆盖白喉、破伤风、百日咳、脊髓灰质炎及b型流感嗜血杆菌等五种传染病。 传统免疫接种程序需要11次注射加2次口服,而五联疫苗可简化为4次注射即可完成全程免疫。这一改进不仅能显著减少婴幼儿的接种次数和痛苦,还能提升家长的接种意愿,优化基层医疗资源配置。凭借“一针多防”的显著优势,该疫苗有望进一步提高我国儿童疫苗接种率与覆盖率。 推动高端疫苗自主化,强化公共健康防线 武汉生物所负责人表示,此次两款产品的成功推进,充分展现了我国在重大传染病防控和高端多联疫苗自主创新领域的研发实力。未来,研究所将继续加强核心技术攻关,推动更多具有自主知识产权的疫苗产品进入临床与市场应用阶段,为全球公共卫生事业贡献“中国方案”。2025-11-24
大家都在看
-
1
荣灿生物获美国专利授权,助力mRNA药物研发新突破
-
2
罗伯医疗获批消化内镜手术机器人,填补国内技术空白
-
3
中国首个IGF-1R抗体药物获批上市,甲状腺眼病治疗迎来新曙光
-
4
广州润尔眼科盐酸依匹斯汀滴眼液获批上市,国内首仿迎来市场竞争新机遇
-
5
孤独症的早期识别与干预:帮助“星星的孩子”走向更好的未来
-
6
重大发现:朊病毒或成胶质母细胞瘤治疗新靶点
-
7
微型心脏起搏器的革新:为新生儿和儿童提供更安全的治疗
-
8
Bright Uro创新发布无导管尿动力学监测系统Glean,获FDA批准
-
9
华东医药司美格鲁肽申报上市,国产GLP-1迎来新突破
-
10
新发现:HDAC2-AS2长非编码RNA在肝细胞癌免疫逃逸中的关键作用
药品推荐
-

替格瑞洛 ticagrelor
适用于急性冠脉综合征患者,如不稳定性心绞痛、非ST段抬高心肌梗死或ST段抬高心肌梗死患者
英国阿斯利康
-

卡麦角林 Cabergoline
治疗帕金森、高催乳素血症及乳腺癌多巴胺D2受体激动剂
美国辉瑞公司(Pfizer Inc.)
-
纳武利尤单抗 Nivolumab
治疗转移性黑色素瘤肾癌肝癌等的免疫药,显著改善生存
美国百时美施贵宝公司(Bristol Myers Squibb)
-
urovaxom Escherichia coli Lysat
用于联合治疗和预防慢性尿路感染,特别是膀胱炎,本品主要用于治疗和预防4岁以上的反复尿路感染
瑞士OM Pharma
-

来那度胺 Lenalidomide
用于多发性骨髓瘤,淋巴瘤中位治疗持续时间延长
印度纳科Natco制药有限公司


