医药资讯
-
 默沙东启动三项IIb期临床试验 评估抗TL1A单抗tulisokibart在多种炎症性疾病中的潜力 2025年10月6日,默沙东宣布其在研抗TL1A人源化单克隆抗体tulisokibart(MK-7240)正式启动三项IIb期临床试验,旨在评估其在三种免疫介导炎症性疾病中的疗效与安全性。这三项研究将在全球范围内招募超过640名患者,进一步验证tulisokibart的治疗潜力。 tulisokibart三项IIb期研究概览 默沙东的三项IIb期研究分别聚焦于以下三种免疫介导炎症性疾病: 化脓性汗腺炎(MK-7240-012, NCT06956235) 化脓性汗腺炎(HS)是一种慢性、复发性皮肤炎症性疾病,以疼痛性结节和脓肿为特征,治疗需求未被完全满足。 影像学轴性脊柱关节炎(MK-7240-013, NCT07133633) 又称强直性脊柱炎(AS),是一种影响脊柱的慢性炎症性疾病,会导致关节僵硬和功能障碍。 类风湿关节炎(MK-7240-014, NCT07176390) 类风湿关节炎(RA)是一种以关节慢性炎症和骨破坏为特征的自身免疫性疾病,目前仍有部分患者对现有治疗药物反应不足。 这些研究的目的是评估tulisokibart在不同疾病中的安全性与疗效,并探索其作用机制带来的广泛临床应用潜力。 tulisokibart:瞄准TL1A的创新疗法 Tulisokibart是一种靶向肿瘤坏死因子样细胞因子1A(TL1A)的在研人源化单克隆抗体。TL1A是一种与肠道炎症和纤维化密切相关的炎症通路分子。在炎症性肠病(IBD)等疾病中,TL1A的异常激活会导致组织损伤和疾病进展。 药物作用原理: Tulisokibart既能结合可溶性TL1A,也能结合膜结合型TL1A,以抑制炎症通路的活化; 通过减少炎症因子释放和抑制纤维化,可能阻止疾病发展。 默沙东在多个疾病领域布局tulisokibart 此次三项新试验的启动将tulisokibart的临床开发扩展到了风湿病学与皮肤病学领域,而其研究重点仍以炎症性肠病为核心。目前,tulisokibart已在以下疾病领域开展临床试验: 炎症性肠病(IBD) ATLAS-UC(NCT06052059):聚焦溃疡性结肠炎(UC)的III期研究; ARES-CD(NCT06430801):聚焦克罗恩病(CD)的III期研究。 风湿病学与皮肤病学 化脓性汗腺炎(HS):IIb期研究; 轴性脊柱关节炎(AS):IIb期研究; 类风湿关节炎(RA):IIb期研究。 系统性硬化症相关间质性肺疾病(SSc-ILD) 针对SSc-ILD的一项II期研究仍在进行中(NCT05270668)。 对多个疾病的试验扩展充分体现了默沙东推动这一创新药物广泛临床转化的战略布局。 专家观点:锁定免疫炎症治疗的新希望 默沙东全球临床开发免疫学副总裁Aileen Pangan博士表示:“tulisokibart的临床开发扩展不仅展示了其治疗潜力,同时也体现了默沙东在解决免疫介导炎症性疾病方面的承诺。我们期望这些试验能够验证tulisokibart在多种疾病中的治疗价值,为患者带来更好的治疗选择。” 未来展望:迈向多种炎症性疾病的治疗突破 Tulisokibart作为靶向TL1A的创新疗法,有望在当前治疗选择有限的炎症性疾病领域带来突破。在未来,随着三项IIb期试验数据的不断积累,以及两项III期研究(ATLAS-UC和ARES-CD)结果的发布,默沙东将有机会进一步推进tulisokibart在全新疾病领域中的应用。 通过深入探索TL1A通路的靶向治疗,tulisokibart不仅有可能填补现有药物的疗效空缺,还将助力炎症性疾病个性化医疗和精准治疗的实现。这一科学进展或将为众多患者带来更大福音。
默沙东启动三项IIb期临床试验 评估抗TL1A单抗tulisokibart在多种炎症性疾病中的潜力 2025年10月6日,默沙东宣布其在研抗TL1A人源化单克隆抗体tulisokibart(MK-7240)正式启动三项IIb期临床试验,旨在评估其在三种免疫介导炎症性疾病中的疗效与安全性。这三项研究将在全球范围内招募超过640名患者,进一步验证tulisokibart的治疗潜力。 tulisokibart三项IIb期研究概览 默沙东的三项IIb期研究分别聚焦于以下三种免疫介导炎症性疾病: 化脓性汗腺炎(MK-7240-012, NCT06956235) 化脓性汗腺炎(HS)是一种慢性、复发性皮肤炎症性疾病,以疼痛性结节和脓肿为特征,治疗需求未被完全满足。 影像学轴性脊柱关节炎(MK-7240-013, NCT07133633) 又称强直性脊柱炎(AS),是一种影响脊柱的慢性炎症性疾病,会导致关节僵硬和功能障碍。 类风湿关节炎(MK-7240-014, NCT07176390) 类风湿关节炎(RA)是一种以关节慢性炎症和骨破坏为特征的自身免疫性疾病,目前仍有部分患者对现有治疗药物反应不足。 这些研究的目的是评估tulisokibart在不同疾病中的安全性与疗效,并探索其作用机制带来的广泛临床应用潜力。 tulisokibart:瞄准TL1A的创新疗法 Tulisokibart是一种靶向肿瘤坏死因子样细胞因子1A(TL1A)的在研人源化单克隆抗体。TL1A是一种与肠道炎症和纤维化密切相关的炎症通路分子。在炎症性肠病(IBD)等疾病中,TL1A的异常激活会导致组织损伤和疾病进展。 药物作用原理: Tulisokibart既能结合可溶性TL1A,也能结合膜结合型TL1A,以抑制炎症通路的活化; 通过减少炎症因子释放和抑制纤维化,可能阻止疾病发展。 默沙东在多个疾病领域布局tulisokibart 此次三项新试验的启动将tulisokibart的临床开发扩展到了风湿病学与皮肤病学领域,而其研究重点仍以炎症性肠病为核心。目前,tulisokibart已在以下疾病领域开展临床试验: 炎症性肠病(IBD) ATLAS-UC(NCT06052059):聚焦溃疡性结肠炎(UC)的III期研究; ARES-CD(NCT06430801):聚焦克罗恩病(CD)的III期研究。 风湿病学与皮肤病学 化脓性汗腺炎(HS):IIb期研究; 轴性脊柱关节炎(AS):IIb期研究; 类风湿关节炎(RA):IIb期研究。 系统性硬化症相关间质性肺疾病(SSc-ILD) 针对SSc-ILD的一项II期研究仍在进行中(NCT05270668)。 对多个疾病的试验扩展充分体现了默沙东推动这一创新药物广泛临床转化的战略布局。 专家观点:锁定免疫炎症治疗的新希望 默沙东全球临床开发免疫学副总裁Aileen Pangan博士表示:“tulisokibart的临床开发扩展不仅展示了其治疗潜力,同时也体现了默沙东在解决免疫介导炎症性疾病方面的承诺。我们期望这些试验能够验证tulisokibart在多种疾病中的治疗价值,为患者带来更好的治疗选择。” 未来展望:迈向多种炎症性疾病的治疗突破 Tulisokibart作为靶向TL1A的创新疗法,有望在当前治疗选择有限的炎症性疾病领域带来突破。在未来,随着三项IIb期试验数据的不断积累,以及两项III期研究(ATLAS-UC和ARES-CD)结果的发布,默沙东将有机会进一步推进tulisokibart在全新疾病领域中的应用。 通过深入探索TL1A通路的靶向治疗,tulisokibart不仅有可能填补现有药物的疗效空缺,还将助力炎症性疾病个性化医疗和精准治疗的实现。这一科学进展或将为众多患者带来更大福音。2025-10-09
-
 赛诺菲BTK抑制剂tolebrutinib获FDA审评时限延长 助力nrSPMS治疗领域突破 2025年9月22日,赛诺菲宣布,美国FDA将对tolebrutinib新药申请(NDA)的审评时限延长了三个月。该药是一种口服、具有脑渗透性的布鲁顿酪氨酸激酶(BTK)抑制剂,用于治疗非复发型继发进展型多发性硬化症(nrSPMS)。此次时限延长来源于审评期间递交的补充分析材料,这些更新资料被FDA认定为重大修订(major amendment),据此将目标审批日(PDUFA date)延后至2025年12月28日。赛诺菲对此药潜在的积极影响充满信心,并表示将在审查过程中继续与FDA保持密切合作。 Tolebrutinib:突破性疗法治疗nrSPMS Tolebrutinib是首个在nrSPMS领域获得FDA突破性疗法认定的脑渗透性BTK抑制剂。其独特作用机制使其能够直接干预中枢神经系统(CNS)固有免疫过程,减缓患者独立于复发活动的残疾累积,这是目前已批准多发性硬化症药物无法涵盖的显著未满足医疗需求。 多发性硬化症中的nrSPMS患者 多发性硬化症(MS)是一种慢性、免疫介导的中枢神经系统退行性疾病,患者随着时间推进可能出现不可逆的残疾累积。 nrSPMS人群特指那些已不再经历复发,但仍处于残疾持续累积状态的MS患者,其症状包括疲劳、认知障碍、步态受损、膀胱功能丧失等,对护理和生活质量造成持久影响。 对nrSPMS患者来说,现有治疗药物多集中于对外周B细胞和T细胞的调控,而对中枢神经系统内免疫过程干预不足。这为tolebrutinib的开发提供了重要临床意义。 审评延迟原因及赛诺菲回应 FDA审评基于HERCULES以及GEMINI 1和2关键III期研究的数据。在审评过程中,赛诺菲向FDA递交了补充分析数据,这些材料被认定为重大修订,促使目标审批日延后至2025年12月28日。赛诺菲表示,并将继续与FDA密切合作,以推动tolebrutinib的审评进展及批准。 临床研究数据支持:HERCULES与GEMINI试验 Tolebrutinib的临床支持数据来源于多个III期试验,其中HERCULES研究专注于nrSPMS患者,而GEMINI 1和2涉及复发型多发性硬化症(RMS)患者的治疗。 HERCULES试验 设计:全球、双盲、随机试验。 目标:评估tolebrutinib在nrSPMS患者中的有效性和安全性。 作用机制:通过干预CNS免疫过程减缓残疾累积,显著改善患者独立于复发的健康指标。 GEMINI 1和2试验 设计:针对RMS患者,评估有效性和安全性。 结果:数据支持tolebrutinib在复发型多发性硬化症领域的治疗潜力。 另外,tolebrutinib还在原发进展型多发性硬化症(PPMS)患者中开展III期PERSEUS研究,预计其结果将在2025年下半年公布。 突破与前景:助力MS治疗领域的下一步 Tolebrutinib作为赛诺菲布局多发性硬化症领域的重要药物,展现了突破性治疗nrSPMS的潜力。其脑渗透性与干预CNS固有免疫过程的创新机制,使其有望填补现有治疗药物的空白。 未来,随着FDA审评的推进以及相关临床数据的陆续公布,tolebrutinib可能成为MS治疗领域的重要成员,为患者提供更全面的治疗选择,提高生活质量,减缓病情进展,在全球范围内改善MS患者的临床管理。 赛诺菲对此药的开发和商业化充满期待,同时打破了针对MS残疾累积治疗的技术瓶颈,为相关免疫性疾病治疗研究提供了新的方向。
赛诺菲BTK抑制剂tolebrutinib获FDA审评时限延长 助力nrSPMS治疗领域突破 2025年9月22日,赛诺菲宣布,美国FDA将对tolebrutinib新药申请(NDA)的审评时限延长了三个月。该药是一种口服、具有脑渗透性的布鲁顿酪氨酸激酶(BTK)抑制剂,用于治疗非复发型继发进展型多发性硬化症(nrSPMS)。此次时限延长来源于审评期间递交的补充分析材料,这些更新资料被FDA认定为重大修订(major amendment),据此将目标审批日(PDUFA date)延后至2025年12月28日。赛诺菲对此药潜在的积极影响充满信心,并表示将在审查过程中继续与FDA保持密切合作。 Tolebrutinib:突破性疗法治疗nrSPMS Tolebrutinib是首个在nrSPMS领域获得FDA突破性疗法认定的脑渗透性BTK抑制剂。其独特作用机制使其能够直接干预中枢神经系统(CNS)固有免疫过程,减缓患者独立于复发活动的残疾累积,这是目前已批准多发性硬化症药物无法涵盖的显著未满足医疗需求。 多发性硬化症中的nrSPMS患者 多发性硬化症(MS)是一种慢性、免疫介导的中枢神经系统退行性疾病,患者随着时间推进可能出现不可逆的残疾累积。 nrSPMS人群特指那些已不再经历复发,但仍处于残疾持续累积状态的MS患者,其症状包括疲劳、认知障碍、步态受损、膀胱功能丧失等,对护理和生活质量造成持久影响。 对nrSPMS患者来说,现有治疗药物多集中于对外周B细胞和T细胞的调控,而对中枢神经系统内免疫过程干预不足。这为tolebrutinib的开发提供了重要临床意义。 审评延迟原因及赛诺菲回应 FDA审评基于HERCULES以及GEMINI 1和2关键III期研究的数据。在审评过程中,赛诺菲向FDA递交了补充分析数据,这些材料被认定为重大修订,促使目标审批日延后至2025年12月28日。赛诺菲表示,并将继续与FDA密切合作,以推动tolebrutinib的审评进展及批准。 临床研究数据支持:HERCULES与GEMINI试验 Tolebrutinib的临床支持数据来源于多个III期试验,其中HERCULES研究专注于nrSPMS患者,而GEMINI 1和2涉及复发型多发性硬化症(RMS)患者的治疗。 HERCULES试验 设计:全球、双盲、随机试验。 目标:评估tolebrutinib在nrSPMS患者中的有效性和安全性。 作用机制:通过干预CNS免疫过程减缓残疾累积,显著改善患者独立于复发的健康指标。 GEMINI 1和2试验 设计:针对RMS患者,评估有效性和安全性。 结果:数据支持tolebrutinib在复发型多发性硬化症领域的治疗潜力。 另外,tolebrutinib还在原发进展型多发性硬化症(PPMS)患者中开展III期PERSEUS研究,预计其结果将在2025年下半年公布。 突破与前景:助力MS治疗领域的下一步 Tolebrutinib作为赛诺菲布局多发性硬化症领域的重要药物,展现了突破性治疗nrSPMS的潜力。其脑渗透性与干预CNS固有免疫过程的创新机制,使其有望填补现有治疗药物的空白。 未来,随着FDA审评的推进以及相关临床数据的陆续公布,tolebrutinib可能成为MS治疗领域的重要成员,为患者提供更全面的治疗选择,提高生活质量,减缓病情进展,在全球范围内改善MS患者的临床管理。 赛诺菲对此药的开发和商业化充满期待,同时打破了针对MS残疾累积治疗的技术瓶颈,为相关免疫性疾病治疗研究提供了新的方向。2025-09-23
-
 Rexulti联合舍曲林治疗PTSD的补充申请被FDA拒绝,研究数据仍存争议 2025年9月20日,大冢制药(Otsuka)与灵北制药(Lundbeck)联合宣布,FDA已向其递交的布瑞哌唑(Rexulti)联合舍曲林治疗创伤后应激障碍(PTSD)的补充新药申请(sNDA)发出完整回复函(CRL)。FDA表示,申请方未能提供足够的实质性有效性证据来支持该适应症获批。 布瑞哌唑:基于多靶点机制的潜力药物 布瑞哌唑是一种多靶点的抗精神类药物,具有5-HT1A受体部分激动、5-HT2A受体拮抗和多巴胺D2受体部分激动的作用机制。自2015年首次在美国获批上市以来,该药已经覆盖重度抑郁症(MDD)、精神分裂症及阿尔茨海默病激越等适应症。然而,在PTSD这一新的适应症拓展中,布瑞哌唑联合舍曲林的研究结果未能获得监管部门的认可。 FDA否决原因:缺乏充分有效性数据 FDA针对布瑞哌唑联合舍曲林治疗PTSD的申请指出,尽管申请资料经过充分审查,但未能提供足够的实质性证据来支持药物的有效性。今年7月,FDA精神药物咨询委员会(PDAC)就该适应症召开会议,委员会以10:1的票数反对联合疗法的有效性,这使得此次审批充满争议。 支持数据综述:疗效存在不一致 该sNDA的申请数据来源于三项随机临床试验:Trial 061、Trial 071和Trial 072,这些试验的主要终点是患者在10周治疗期间,其CAPS-5量表(PTSD症状评分)总分的变化。但结果却并不完全一致: Trial 061(II期临床研究): 布瑞哌唑+舍曲林组CAPS-5总分下降16.4分,显著优于布瑞哌唑单药组(-12.2分)、舍曲林单药组(-11.4分)和安慰剂组(-10.5分)。 Trial 071(III期临床研究): 布瑞哌唑+舍曲林组相比舍曲林+安慰剂组,CAPS-5总分显著下降(-19.2分 vs -13.6分,P<0.001),显示了优越性。 Trial 072(III期临床研究): 研究未能达到主要终点(CAPS-5总分差异:-18.3分 vs -17.6分,P=0.66),但趋势上仍与Trial 061和071一致。 尽管两项研究中布瑞哌唑+舍曲林显示出一定效果,但Trial 072未能显现统计学显著性。FDA可能认为这些数据不足以全面支持该适应症的批准。 安全性结果:耐受性良好 三项试验的一致数据显示,布瑞哌唑+舍曲林治疗PTSD的安全性和耐受性良好,且未发现新的不良反应。合并分析显示: 治疗期间不良事件(TEAE)发生率:布瑞哌唑+舍曲林组为55.5%,舍曲林+安慰剂组为56.2%。 常见的不良事件包括恶心、头痛、体重增加和腹泻。 现状与挑战:PTSD治疗仍显不足 PTSD作为常见的心理健康障碍之一,美国每年约有1300万患者确诊。至目前,FDA仅批准舍曲林和帕罗西汀两种药物用于PTSD治疗,但是这类药物的有效率低于60%,完全缓解率甚至仅为20%-30%。其他尝试申报的候选药物(如MDMA)由于争议较大也未能获批,这表明PTSD药物开发依然面临严峻挑战。 未来方向:重新审视适应症拓展策略 尽管FDA拒绝了布瑞哌唑联合舍曲林的sNDA,但大冢和灵北表示将继续探索PTSD治疗的可能性,这可能包括: 重新设计更强大的临床试验:明确靶向治疗的特定患者群体; 改善药物疗效的联合策略:探索更优化的剂量方案或联合疗法; 创新疗效评估方法:引入更敏感的评估工具,更早发现治疗信号。 总结 布瑞哌唑联合舍曲林治疗PTSD的适应症申请未获FDA批准,主要因现有临床数据的实质性有效性证据不足。然而,这一案例突显了PTSD治疗领域的巨大未满足需求,也为未来候选药物的研发提出了更高挑战。随着科学家进一步优化研究设计并挖掘潜在治疗机制,或许未来可以为PTSD患者提供更有效的治疗选择。
Rexulti联合舍曲林治疗PTSD的补充申请被FDA拒绝,研究数据仍存争议 2025年9月20日,大冢制药(Otsuka)与灵北制药(Lundbeck)联合宣布,FDA已向其递交的布瑞哌唑(Rexulti)联合舍曲林治疗创伤后应激障碍(PTSD)的补充新药申请(sNDA)发出完整回复函(CRL)。FDA表示,申请方未能提供足够的实质性有效性证据来支持该适应症获批。 布瑞哌唑:基于多靶点机制的潜力药物 布瑞哌唑是一种多靶点的抗精神类药物,具有5-HT1A受体部分激动、5-HT2A受体拮抗和多巴胺D2受体部分激动的作用机制。自2015年首次在美国获批上市以来,该药已经覆盖重度抑郁症(MDD)、精神分裂症及阿尔茨海默病激越等适应症。然而,在PTSD这一新的适应症拓展中,布瑞哌唑联合舍曲林的研究结果未能获得监管部门的认可。 FDA否决原因:缺乏充分有效性数据 FDA针对布瑞哌唑联合舍曲林治疗PTSD的申请指出,尽管申请资料经过充分审查,但未能提供足够的实质性证据来支持药物的有效性。今年7月,FDA精神药物咨询委员会(PDAC)就该适应症召开会议,委员会以10:1的票数反对联合疗法的有效性,这使得此次审批充满争议。 支持数据综述:疗效存在不一致 该sNDA的申请数据来源于三项随机临床试验:Trial 061、Trial 071和Trial 072,这些试验的主要终点是患者在10周治疗期间,其CAPS-5量表(PTSD症状评分)总分的变化。但结果却并不完全一致: Trial 061(II期临床研究): 布瑞哌唑+舍曲林组CAPS-5总分下降16.4分,显著优于布瑞哌唑单药组(-12.2分)、舍曲林单药组(-11.4分)和安慰剂组(-10.5分)。 Trial 071(III期临床研究): 布瑞哌唑+舍曲林组相比舍曲林+安慰剂组,CAPS-5总分显著下降(-19.2分 vs -13.6分,P<0.001),显示了优越性。 Trial 072(III期临床研究): 研究未能达到主要终点(CAPS-5总分差异:-18.3分 vs -17.6分,P=0.66),但趋势上仍与Trial 061和071一致。 尽管两项研究中布瑞哌唑+舍曲林显示出一定效果,但Trial 072未能显现统计学显著性。FDA可能认为这些数据不足以全面支持该适应症的批准。 安全性结果:耐受性良好 三项试验的一致数据显示,布瑞哌唑+舍曲林治疗PTSD的安全性和耐受性良好,且未发现新的不良反应。合并分析显示: 治疗期间不良事件(TEAE)发生率:布瑞哌唑+舍曲林组为55.5%,舍曲林+安慰剂组为56.2%。 常见的不良事件包括恶心、头痛、体重增加和腹泻。 现状与挑战:PTSD治疗仍显不足 PTSD作为常见的心理健康障碍之一,美国每年约有1300万患者确诊。至目前,FDA仅批准舍曲林和帕罗西汀两种药物用于PTSD治疗,但是这类药物的有效率低于60%,完全缓解率甚至仅为20%-30%。其他尝试申报的候选药物(如MDMA)由于争议较大也未能获批,这表明PTSD药物开发依然面临严峻挑战。 未来方向:重新审视适应症拓展策略 尽管FDA拒绝了布瑞哌唑联合舍曲林的sNDA,但大冢和灵北表示将继续探索PTSD治疗的可能性,这可能包括: 重新设计更强大的临床试验:明确靶向治疗的特定患者群体; 改善药物疗效的联合策略:探索更优化的剂量方案或联合疗法; 创新疗效评估方法:引入更敏感的评估工具,更早发现治疗信号。 总结 布瑞哌唑联合舍曲林治疗PTSD的适应症申请未获FDA批准,主要因现有临床数据的实质性有效性证据不足。然而,这一案例突显了PTSD治疗领域的巨大未满足需求,也为未来候选药物的研发提出了更高挑战。随着科学家进一步优化研究设计并挖掘潜在治疗机制,或许未来可以为PTSD患者提供更有效的治疗选择。2025-09-23
-
 信达生物玛仕度肽新适应症获批:助力2型糖尿病患者实现血糖与体重双重管理 2025年9月19日,国家药品监督管理局(NMPA)官网公示,信达生物的GLP-1R/GCGR双重激动剂玛仕度肽成功获批用于成人2型糖尿病患者血糖控制。这是玛仕度肽继适用于肥胖或超重患者后获批的第二个适应症,为中国广大糖尿病患者提供了新的综合管理方案。 玛仕度肽:创新GLP-1R/GCGR双重激动剂 玛仕度肽是信达生物与礼来制药联合开发的药物,作为全球首款GLP-1R/GCGR双重激动剂,它不仅通过GLP-1受体激动促进胰岛素分泌、降低血糖,还能通过GCGR的激动作用增加能量消耗并促进减重,同时改善肝脏脂肪代谢,展现出显著的治疗效果和广泛的临床潜力。 支持获批的关键研究:DREAMS-1与DREAMS-2 玛仕度肽新适应症的获批主要基于两项关键性III期临床研究结果。这两项研究分别验证了玛仕度肽单药(DREAMS-1)以及联合口服降糖药(DREAMS-2)在中国2型糖尿病患者中的优异疗效与安全性。 DREAMS-1:单药治疗的显著成效 受试者情况:入组320例经饮食运动控制不佳的中国2型糖尿病患者,随机接受玛仕度肽4 mg、6 mg或安慰剂治疗。 主要结果: 第24周时,玛仕度肽4mg和6mg组糖化血红蛋白(HbA1c)较基线分别下降1.57%和2.15%,远优于安慰剂组(-0.14%); HbA1c<7.0%的受试者比例:玛仕度肽4mg和6mg组分别为68.6%和87.4%(安慰剂组为10.7%)。 减重表现: 体重较基线平均下降5.61%和7.81%,显著优于安慰剂组(-1.26%); HbA1c<7.0%且体重下降≥5%的比例高达40.6%和64.9%(安慰剂组为0%。 DREAMS-2:联合治疗更优于度拉糖肽 受试者情况:入组731例经二甲双胍或联合其他口服药物治疗血糖控制不佳的患者,随机接受玛仕度肽4mg、6mg或度拉糖肽1.5mg治疗。 主要结果: 第28周时,玛仕度肽4mg和6mg组HbA1c较基线下降1.69%和1.73%,显著优于度拉糖肽组(1.36%); HbA1c<7.0%的达标率为71.2%和74.2%,显著高于度拉糖肽组(62.1%)。 减重表现: 体重较基线平均下降9.24%和7.13%,显著优于度拉糖肽组(2.86%); HbA1c<7.0%且体重下降≥5%的比例分别为50.1%和64.3%(度拉糖肽组仅为19.4%)。 此外,两项研究中,玛仕度肽在改善空腹血糖、餐后血糖、腰围、血压及肝脏指标等方面也表现出显著优势,安全性与既往临床研究保持一致,未发现新的风险信号。 临床开发与市场前景 玛仕度肽目前已开展七项III期临床试验,覆盖肥胖、体重管理、脂肪肝及OSA等领域,其中“GLORY-1”和“DREAMS-1”已达成终点。在治疗2型糖尿病方面,DREAMS-2和相关研究使玛仕度肽成为全球首个在这一领域取得成功的GLP-1R/GCGR双重激动剂。 重要性还在于玛仕度肽下一步计划启动的临床试验,包括治疗青少年肥胖、射血分数保留心力衰竭(HFpEF)、代谢性脂肪性肝炎(MASH),甚至更高剂量头对头对比替尔泊肽用于肥胖治疗,其长期市场前景广阔。 总结:革新解决方案为中国糖尿病患者带来福音 玛仕度肽作为全球首个在2型糖尿病中取得临床成功的GLP-1R/GCGR双重激动剂,不仅实现了血糖控制、体重减轻与代谢指标改善等多重效果,还为中国糖尿病患者的疾病综合管理提供了全新治疗方案。随着更多临床数据的积累和适应症的潜在扩展,玛仕度肽有望成为糖尿病和代谢疾病领域的重要创新药物,造福更多患者。
信达生物玛仕度肽新适应症获批:助力2型糖尿病患者实现血糖与体重双重管理 2025年9月19日,国家药品监督管理局(NMPA)官网公示,信达生物的GLP-1R/GCGR双重激动剂玛仕度肽成功获批用于成人2型糖尿病患者血糖控制。这是玛仕度肽继适用于肥胖或超重患者后获批的第二个适应症,为中国广大糖尿病患者提供了新的综合管理方案。 玛仕度肽:创新GLP-1R/GCGR双重激动剂 玛仕度肽是信达生物与礼来制药联合开发的药物,作为全球首款GLP-1R/GCGR双重激动剂,它不仅通过GLP-1受体激动促进胰岛素分泌、降低血糖,还能通过GCGR的激动作用增加能量消耗并促进减重,同时改善肝脏脂肪代谢,展现出显著的治疗效果和广泛的临床潜力。 支持获批的关键研究:DREAMS-1与DREAMS-2 玛仕度肽新适应症的获批主要基于两项关键性III期临床研究结果。这两项研究分别验证了玛仕度肽单药(DREAMS-1)以及联合口服降糖药(DREAMS-2)在中国2型糖尿病患者中的优异疗效与安全性。 DREAMS-1:单药治疗的显著成效 受试者情况:入组320例经饮食运动控制不佳的中国2型糖尿病患者,随机接受玛仕度肽4 mg、6 mg或安慰剂治疗。 主要结果: 第24周时,玛仕度肽4mg和6mg组糖化血红蛋白(HbA1c)较基线分别下降1.57%和2.15%,远优于安慰剂组(-0.14%); HbA1c<7.0%的受试者比例:玛仕度肽4mg和6mg组分别为68.6%和87.4%(安慰剂组为10.7%)。 减重表现: 体重较基线平均下降5.61%和7.81%,显著优于安慰剂组(-1.26%); HbA1c<7.0%且体重下降≥5%的比例高达40.6%和64.9%(安慰剂组为0%。 DREAMS-2:联合治疗更优于度拉糖肽 受试者情况:入组731例经二甲双胍或联合其他口服药物治疗血糖控制不佳的患者,随机接受玛仕度肽4mg、6mg或度拉糖肽1.5mg治疗。 主要结果: 第28周时,玛仕度肽4mg和6mg组HbA1c较基线下降1.69%和1.73%,显著优于度拉糖肽组(1.36%); HbA1c<7.0%的达标率为71.2%和74.2%,显著高于度拉糖肽组(62.1%)。 减重表现: 体重较基线平均下降9.24%和7.13%,显著优于度拉糖肽组(2.86%); HbA1c<7.0%且体重下降≥5%的比例分别为50.1%和64.3%(度拉糖肽组仅为19.4%)。 此外,两项研究中,玛仕度肽在改善空腹血糖、餐后血糖、腰围、血压及肝脏指标等方面也表现出显著优势,安全性与既往临床研究保持一致,未发现新的风险信号。 临床开发与市场前景 玛仕度肽目前已开展七项III期临床试验,覆盖肥胖、体重管理、脂肪肝及OSA等领域,其中“GLORY-1”和“DREAMS-1”已达成终点。在治疗2型糖尿病方面,DREAMS-2和相关研究使玛仕度肽成为全球首个在这一领域取得成功的GLP-1R/GCGR双重激动剂。 重要性还在于玛仕度肽下一步计划启动的临床试验,包括治疗青少年肥胖、射血分数保留心力衰竭(HFpEF)、代谢性脂肪性肝炎(MASH),甚至更高剂量头对头对比替尔泊肽用于肥胖治疗,其长期市场前景广阔。 总结:革新解决方案为中国糖尿病患者带来福音 玛仕度肽作为全球首个在2型糖尿病中取得临床成功的GLP-1R/GCGR双重激动剂,不仅实现了血糖控制、体重减轻与代谢指标改善等多重效果,还为中国糖尿病患者的疾病综合管理提供了全新治疗方案。随着更多临床数据的积累和适应症的潜在扩展,玛仕度肽有望成为糖尿病和代谢疾病领域的重要创新药物,造福更多患者。2025-09-22
-
 康诺亚双抗药物CM336进入III期临床研究:靶向治疗复发或难治性多发性骨髓瘤 2025年9月18日,全球临床试验收录网站显示,康诺亚生物研发的一款双抗药物CM336已正式启动首个III期临床研究。这标志着CM336成为康诺亚旗下进入III期阶段的首款双抗药物,并在复发或难治性多发性骨髓瘤(R/R MM)领域迈出了关键一步。 CM336的作用机制:靶向CD3和BCMA CM336是一款靶向T细胞上的CD3和靶细胞上的B细胞成熟抗原(BCMA)的双特异性抗体,通过桥接T细胞和靶细胞,诱导T细胞依赖性细胞毒(TDCC)作用,从而消除肿瘤细胞。这种创新机制使CM336在多发性骨髓瘤的治疗中展现出了显著潜力。 III期研究设计:展现安全性与有效性 此次启动的III期临床试验是一项随机、开放标签、多中心研究,共纳入280例患者,旨在评估CM336作为单药治疗对比研究者选择的标准治疗方案,在既往接受过至少两线治疗的R/R MM患者中的疗效及安全性。 主要终点:无进展生存期(PFS)。 研究范围:III期研究将在多个中心展开,进一步验证CM336的疗效和安全性,为未来的药物注册上市铺设基础。 I/II期研究成果:疗效显著 在此前完成的针对R/R MM患者的I/II期临床研究中,CM336已表现出良好的疗效和耐受性。 剂量递增队列:23名患者参与评估,随访中位时间为12.1个月。 ≤5mg组:客观缓解率(ORR)为17%;严格的完全缓解或完全缓解比例为17%。 20-40mg组:ORR为71%;严格的完全缓解或完全缓解比例为71%。 80-160mg组:ORR最高,达80%;严格的完全缓解或完全缓解比例为60%。 CM336在较高剂量组的显著疗效,为其进一步开发提供了强有力的临床依据。 市场前景:填补多发性骨髓瘤治疗的空白 多发性骨髓瘤是一种难治性血液恶性肿瘤,患者在接受多线治疗后复发的概率较高,临床需求未被充分满足。CM336通过靶向BCMA这一关键分子,为复发或难治性多发性骨髓瘤的治疗提供了新的可能。 作为康诺亚首款进入III期研究的双抗药物,CM336的成功不仅助推公司在抗体药物研发中的领先地位,也为治疗难治性血液恶性肿瘤打开了新的突破方向。 总结 CM336通过独特的靶向机制,在高剂量组的临床疗效令人瞩目。此次III期试验的启动,标志着该药物距离临床应用更近一步,也为R/R MM患者带来新的治疗选择。随着临床研究的持续推进,CM336有望迈向市场,为广大患者提供更加高效且精准的治疗方案。
康诺亚双抗药物CM336进入III期临床研究:靶向治疗复发或难治性多发性骨髓瘤 2025年9月18日,全球临床试验收录网站显示,康诺亚生物研发的一款双抗药物CM336已正式启动首个III期临床研究。这标志着CM336成为康诺亚旗下进入III期阶段的首款双抗药物,并在复发或难治性多发性骨髓瘤(R/R MM)领域迈出了关键一步。 CM336的作用机制:靶向CD3和BCMA CM336是一款靶向T细胞上的CD3和靶细胞上的B细胞成熟抗原(BCMA)的双特异性抗体,通过桥接T细胞和靶细胞,诱导T细胞依赖性细胞毒(TDCC)作用,从而消除肿瘤细胞。这种创新机制使CM336在多发性骨髓瘤的治疗中展现出了显著潜力。 III期研究设计:展现安全性与有效性 此次启动的III期临床试验是一项随机、开放标签、多中心研究,共纳入280例患者,旨在评估CM336作为单药治疗对比研究者选择的标准治疗方案,在既往接受过至少两线治疗的R/R MM患者中的疗效及安全性。 主要终点:无进展生存期(PFS)。 研究范围:III期研究将在多个中心展开,进一步验证CM336的疗效和安全性,为未来的药物注册上市铺设基础。 I/II期研究成果:疗效显著 在此前完成的针对R/R MM患者的I/II期临床研究中,CM336已表现出良好的疗效和耐受性。 剂量递增队列:23名患者参与评估,随访中位时间为12.1个月。 ≤5mg组:客观缓解率(ORR)为17%;严格的完全缓解或完全缓解比例为17%。 20-40mg组:ORR为71%;严格的完全缓解或完全缓解比例为71%。 80-160mg组:ORR最高,达80%;严格的完全缓解或完全缓解比例为60%。 CM336在较高剂量组的显著疗效,为其进一步开发提供了强有力的临床依据。 市场前景:填补多发性骨髓瘤治疗的空白 多发性骨髓瘤是一种难治性血液恶性肿瘤,患者在接受多线治疗后复发的概率较高,临床需求未被充分满足。CM336通过靶向BCMA这一关键分子,为复发或难治性多发性骨髓瘤的治疗提供了新的可能。 作为康诺亚首款进入III期研究的双抗药物,CM336的成功不仅助推公司在抗体药物研发中的领先地位,也为治疗难治性血液恶性肿瘤打开了新的突破方向。 总结 CM336通过独特的靶向机制,在高剂量组的临床疗效令人瞩目。此次III期试验的启动,标志着该药物距离临床应用更近一步,也为R/R MM患者带来新的治疗选择。随着临床研究的持续推进,CM336有望迈向市场,为广大患者提供更加高效且精准的治疗方案。2025-09-22
-
 正大天晴注射用醋酸地加瑞克(晴立舒®)获批上市,打破原研药市场垄断 2025年9月15日,国家药品监督管理局官网显示,正大天晴药业集团自主研发的注射用醋酸地加瑞克(商品名:晴立舒®)正式获批上市,用于需接受雄激素去势治疗的前列腺癌患者。作为全球首款上市的地加瑞克仿制药,晴立舒®一举打破了原研药费蒙格®长达十余年的市场垄断,为国内前列腺癌患者提供了更多治疗选择,同时显著降低了用药成本。 前列腺癌疾病负担加重,治疗需求持续上升 前列腺癌是男性泌尿生殖系统中最常见的恶性肿瘤之一,也是男性第二大常见癌症。随着老龄化社会加剧,其发病率逐年攀升,已成为困扰全球男性健康的重要疾病之一。患者对高效且副作用更低的治疗方案需求日益迫切。 晴立舒®:GnRHR拮抗剂的高效治疗选择 醋酸地加瑞克是一种选择性的促性腺激素释放激素受体(GnRHR)拮抗剂,在晚期前列腺癌治疗中展现了卓越效果。 治疗优势: 快速降低睾酮:地加瑞克能够快速有效降低患者睾酮水平,避免传统GnRH激动剂常见的“睾酮反跳”现象; 降低心血管风险:相比于GnRH激动剂,GnRHR拮抗剂对既往有心血管疾病史的患者能更好地减少心血管事件发生风险; 与原研药疗效一致:临床研究表明,晴立舒®在疗效和安全性方面可与原研药媲美,为患者提供同等质量但更为经济的治疗选择。 全球首仿:展现国际领先水平 晴立舒®不仅获得中国NMPA批准,还在欧盟市场获批上市,并在美国获得暂时批准,彰显了正大天晴在复杂制剂研发领域的强大实力。这标志着中国本土药企在国际市场上已经具备了强劲的竞争力。 专利挑战成功,获市场独占期 在国内申报上市过程中,正大天晴同步发起了专利挑战,成功宣告原研药的两项核心关键专利无效,包括医药用途专利(ZL200980104713.X)和制剂组合物专利(ZL201380028448.8)。晴立舒®因此成为我国药品专利链接制度实施以来,又一个获得“12个月市场独占期”的药品。此举不但打破了原研药在国内的市场独占地位,还进一步推动了市场竞争,降低了患者的经济负担。 助力患者减负,降低用药成本 原研药费蒙格®(辉凌制药研发,由辉瑞和安斯泰来分别在中国和日本拥有权益)2024年全球销售额突破13亿美元,并已通过医保谈判成功进入中国新版医保目录。然而,其高昂价格对患者依然构成沉重经济压力。晴立舒®的上市,将进一步降低药物价格,极大地减轻患者的经济负担。 未来展望:前列腺癌市场的活力与挑战 随着晴立舒®作为全球首仿药的上市,国内前列腺癌用药市场将迎来新的竞争格局。“首仿+专利挑战”的成功模式,为我国药企在高端竞争领域实现突围提供了良好示范。未来,随着更多创新药物的出现,前列腺癌患者将获得更丰富的治疗选择,迎来更加可负担且有效的治疗方案。 晴立舒®的成功上市不仅是正大天晴在创新药物研发上的又一次突破,也为我国在国际药物市场的崛起做出了表率。正大天晴表示,将持续推进高质量仿制药和创新药的研发布局,为更多患者提供优质治疗方案,改善患者生活质量,提升用药可及性。
正大天晴注射用醋酸地加瑞克(晴立舒®)获批上市,打破原研药市场垄断 2025年9月15日,国家药品监督管理局官网显示,正大天晴药业集团自主研发的注射用醋酸地加瑞克(商品名:晴立舒®)正式获批上市,用于需接受雄激素去势治疗的前列腺癌患者。作为全球首款上市的地加瑞克仿制药,晴立舒®一举打破了原研药费蒙格®长达十余年的市场垄断,为国内前列腺癌患者提供了更多治疗选择,同时显著降低了用药成本。 前列腺癌疾病负担加重,治疗需求持续上升 前列腺癌是男性泌尿生殖系统中最常见的恶性肿瘤之一,也是男性第二大常见癌症。随着老龄化社会加剧,其发病率逐年攀升,已成为困扰全球男性健康的重要疾病之一。患者对高效且副作用更低的治疗方案需求日益迫切。 晴立舒®:GnRHR拮抗剂的高效治疗选择 醋酸地加瑞克是一种选择性的促性腺激素释放激素受体(GnRHR)拮抗剂,在晚期前列腺癌治疗中展现了卓越效果。 治疗优势: 快速降低睾酮:地加瑞克能够快速有效降低患者睾酮水平,避免传统GnRH激动剂常见的“睾酮反跳”现象; 降低心血管风险:相比于GnRH激动剂,GnRHR拮抗剂对既往有心血管疾病史的患者能更好地减少心血管事件发生风险; 与原研药疗效一致:临床研究表明,晴立舒®在疗效和安全性方面可与原研药媲美,为患者提供同等质量但更为经济的治疗选择。 全球首仿:展现国际领先水平 晴立舒®不仅获得中国NMPA批准,还在欧盟市场获批上市,并在美国获得暂时批准,彰显了正大天晴在复杂制剂研发领域的强大实力。这标志着中国本土药企在国际市场上已经具备了强劲的竞争力。 专利挑战成功,获市场独占期 在国内申报上市过程中,正大天晴同步发起了专利挑战,成功宣告原研药的两项核心关键专利无效,包括医药用途专利(ZL200980104713.X)和制剂组合物专利(ZL201380028448.8)。晴立舒®因此成为我国药品专利链接制度实施以来,又一个获得“12个月市场独占期”的药品。此举不但打破了原研药在国内的市场独占地位,还进一步推动了市场竞争,降低了患者的经济负担。 助力患者减负,降低用药成本 原研药费蒙格®(辉凌制药研发,由辉瑞和安斯泰来分别在中国和日本拥有权益)2024年全球销售额突破13亿美元,并已通过医保谈判成功进入中国新版医保目录。然而,其高昂价格对患者依然构成沉重经济压力。晴立舒®的上市,将进一步降低药物价格,极大地减轻患者的经济负担。 未来展望:前列腺癌市场的活力与挑战 随着晴立舒®作为全球首仿药的上市,国内前列腺癌用药市场将迎来新的竞争格局。“首仿+专利挑战”的成功模式,为我国药企在高端竞争领域实现突围提供了良好示范。未来,随着更多创新药物的出现,前列腺癌患者将获得更丰富的治疗选择,迎来更加可负担且有效的治疗方案。 晴立舒®的成功上市不仅是正大天晴在创新药物研发上的又一次突破,也为我国在国际药物市场的崛起做出了表率。正大天晴表示,将持续推进高质量仿制药和创新药的研发布局,为更多患者提供优质治疗方案,改善患者生活质量,提升用药可及性。2025-09-19
-
 康宁杰瑞/石药集团HER2双抗KN026新药申请获受理:填补胃癌二线治疗空白 近日,国家药品监督管理局药品审评中心(CDE)官网信息显示,由康宁杰瑞与石药集团联合开发的HER2双特异性抗体KN026(安尼妥单抗注射液)新药上市申请(NDA)已获受理,适应症为“联合化疗用于HER2阳性胃癌二线治疗”。这标志着中国首个进入胃癌二线治疗适应症NDA流程的HER2双抗药物,也使KN026成为全球同类药物中进度最快的一款。 关键研究成果支撑KN026的优越性 此次NDA申请基于一项关键性II/III期临床研究(KC-WISE)的积极结果。研究显示,与对照组相比,KN026联合化疗在HER2阳性胃癌患者中显著延长了无进展生存期(PFS)和总生存期(OS)。特别针对一线曲妥珠单抗治疗失败的患者,KN026展现了卓越的疗效和安全优势。因其在临床上的突出表现,KN026此前已被授予“突破性治疗药物资格”,并于2025年8月底获优先审评资格,这表明药物审批进程或将大大加速。 填补HER2阳性胃癌二线治疗空白 目前,在胃癌患者中,HER2阳性约占15%-20%。尽管曲妥珠单抗是一线治疗的标准抗体药物,但在一线治疗失败的患者中,二线治疗领域尚无获批的抗HER2药物,这使得临床医生面临治疗选择严重不足的困境。KN026的试验结果不仅达到了II/III期临床研究的主要终点,还成为中国首个在胃癌二线治疗中取得阳性疗效的HER2双抗药物,为患者群体带来了新的治疗希望。 KN026的核心创新点:双靶点协同强化抗瘤作用 KN026作为一款具有差异化价值的抗HER2双特异性抗体,创新性地同时结合HER2的两个不同表位,实现类似曲妥珠单抗与帕妥珠单抗协同作用的效果。具体机制如下: 信号阻断增强:通过双表位结合,显著强化HER2信号通路的阻滞效果; 抑瘤活性提升:克服潜在的耐药机制,为曲妥珠单抗治疗失败的患者带来治疗可能; 优化安全性与耐受性:确保患者在治疗过程中获得更好的生存质量。 这些特点使KN026精准切入HER2阳性胃癌的二线治疗缺口,成为患者群体亟需的潜在解决方案。 未来展望:多适应症布局显示广阔潜力 除了胃癌二线治疗外,KN026还在乳腺癌(III期)、结直肠癌、多发骨转移等多个瘤种中积极布局。其从机制设计到临床开发的全面创新,使其呈现出广阔的发展潜力: 乳腺癌适应症:目前正在III期试验阶段,有望进一步丰富HER2阳性乳腺癌患者的治疗方案; 结直肠癌与其他瘤种:正在探索中的适应症为其市场拓展提供更多机会。 总结:改写胃癌二线治疗格局的里程碑 KN026作为中国首个在胃癌二线治疗中完成NDA申请的HER2双抗,不仅是HER2靶向治疗领域的重大进展,也象征着国产创新药物在全球范围内的加速追赶与崛起。未来,随着更多适应症的临床试验结果的公布,KN026有望成为HER2相关肿瘤群体中的多面手,为广大患者提供更精准、高效的治疗选择。 这标志着中国本土生物制药领域向全球创新高地迈出的又一坚实步伐。
康宁杰瑞/石药集团HER2双抗KN026新药申请获受理:填补胃癌二线治疗空白 近日,国家药品监督管理局药品审评中心(CDE)官网信息显示,由康宁杰瑞与石药集团联合开发的HER2双特异性抗体KN026(安尼妥单抗注射液)新药上市申请(NDA)已获受理,适应症为“联合化疗用于HER2阳性胃癌二线治疗”。这标志着中国首个进入胃癌二线治疗适应症NDA流程的HER2双抗药物,也使KN026成为全球同类药物中进度最快的一款。 关键研究成果支撑KN026的优越性 此次NDA申请基于一项关键性II/III期临床研究(KC-WISE)的积极结果。研究显示,与对照组相比,KN026联合化疗在HER2阳性胃癌患者中显著延长了无进展生存期(PFS)和总生存期(OS)。特别针对一线曲妥珠单抗治疗失败的患者,KN026展现了卓越的疗效和安全优势。因其在临床上的突出表现,KN026此前已被授予“突破性治疗药物资格”,并于2025年8月底获优先审评资格,这表明药物审批进程或将大大加速。 填补HER2阳性胃癌二线治疗空白 目前,在胃癌患者中,HER2阳性约占15%-20%。尽管曲妥珠单抗是一线治疗的标准抗体药物,但在一线治疗失败的患者中,二线治疗领域尚无获批的抗HER2药物,这使得临床医生面临治疗选择严重不足的困境。KN026的试验结果不仅达到了II/III期临床研究的主要终点,还成为中国首个在胃癌二线治疗中取得阳性疗效的HER2双抗药物,为患者群体带来了新的治疗希望。 KN026的核心创新点:双靶点协同强化抗瘤作用 KN026作为一款具有差异化价值的抗HER2双特异性抗体,创新性地同时结合HER2的两个不同表位,实现类似曲妥珠单抗与帕妥珠单抗协同作用的效果。具体机制如下: 信号阻断增强:通过双表位结合,显著强化HER2信号通路的阻滞效果; 抑瘤活性提升:克服潜在的耐药机制,为曲妥珠单抗治疗失败的患者带来治疗可能; 优化安全性与耐受性:确保患者在治疗过程中获得更好的生存质量。 这些特点使KN026精准切入HER2阳性胃癌的二线治疗缺口,成为患者群体亟需的潜在解决方案。 未来展望:多适应症布局显示广阔潜力 除了胃癌二线治疗外,KN026还在乳腺癌(III期)、结直肠癌、多发骨转移等多个瘤种中积极布局。其从机制设计到临床开发的全面创新,使其呈现出广阔的发展潜力: 乳腺癌适应症:目前正在III期试验阶段,有望进一步丰富HER2阳性乳腺癌患者的治疗方案; 结直肠癌与其他瘤种:正在探索中的适应症为其市场拓展提供更多机会。 总结:改写胃癌二线治疗格局的里程碑 KN026作为中国首个在胃癌二线治疗中完成NDA申请的HER2双抗,不仅是HER2靶向治疗领域的重大进展,也象征着国产创新药物在全球范围内的加速追赶与崛起。未来,随着更多适应症的临床试验结果的公布,KN026有望成为HER2相关肿瘤群体中的多面手,为广大患者提供更精准、高效的治疗选择。 这标志着中国本土生物制药领域向全球创新高地迈出的又一坚实步伐。2025-09-19
-
 阿斯利康司美替尼口服颗粒剂获FDA批准 扩展适用人群至1岁及以上儿科患者 2025年9月10日,FDA官网公布,阿斯利康的司美替尼(selumetinib)口服颗粒剂获批上市,全面扩展适用人群至1岁及以上有症状且无法手术的1型神经纤维瘤病(NF1)相关丛状神经纤维瘤(PN)儿科患者。同时,司美替尼口服胶囊剂的适用年龄也同步扩大,从之前的2岁及以上扩展至1岁及以上儿科患者。这一批准标志着司美替尼在治疗NF1相关PN领域的适用范围进一步扩展,为更多低龄患者提供有效治疗方案。 司美替尼:MEK抑制剂的首个针对NF1相关疾病的获批药物 司美替尼是一款由Array BioPharma(辉瑞子公司)开发的丝裂原活化蛋白激酶激酶1和2(MEK1/2)抑制剂,商品名为Koselugo。该药物于2020年首次获批上市,是针对NF1相关丛状神经纤维瘤的首个药物治疗选择。司美替尼通过抑制MEK1/2信号通路活性,改善NF1相关PN的症状与病程。 阿斯利康于2003年从Array BioPharma处获得司美替尼全球权益,并于2017年与默沙东合作,共同推进该药在全球的开发及商业化。目前,司美替尼在多个国家已上市,其适用人群涵盖不同年龄段的NF1患者: 2020年 首次获批美国上市,适用于2岁及以上儿科患者; 2021年 获欧洲批准上市,适用范围为3岁及以上儿科患者; 2023年 在中国获批,适用范围与欧洲一致,为3岁及以上儿科患者。 批准依据:临床桥接及多项试验支持扩展适用人群 此次批准依据一系列研究数据,包括健康成人中的相对生物利用度桥接研究及多项针对儿科患者的临床试验: 桥接研究(Study 89):提供了司美替尼胶囊剂与颗粒剂在健康成人中的相对生物利用度数据,显示两种制剂的药物暴露量类似。 SPRINT和Stratum研究:这两项针对2岁及以上儿科患者的临床研究验证了司美替尼胶囊剂的有效性与安全性。 SPRINKLE研究:针对1岁及以上儿科患者的I/II期研究,进一步提供了司美替尼颗粒剂的有效性与耐受性数据。 这些研究共同支持适用人群的年龄外推至1岁及以上,并验证颗粒剂与胶囊剂在临床使用中的等效性。 安全性:包括更多儿科数据的更新 司美替尼的处方信息已更新警告和注意事项,涵盖更多儿科患者数据。这些包括: 心肌病 眼毒性 胃肠道毒性 皮肤毒性 肌酸磷酸激酶升高 出血风险增加(仅胶囊剂) 维生素E水平升高 胚胎毒性 FDA指出,目前未发现新的安全性信号,司美替尼在儿科患者中的安全性风险仍处于可控范围。 司美替尼的全球治疗覆盖 随着颗粒剂和胶囊剂的适用人群年龄扩展,司美替尼进一步巩固了其在NF1相关PN治疗领域的领导地位。然而,不同地区对司美替尼适合治疗年龄的规定仍有所不同: 美国:适用范围扩大至1岁及以上患者; 欧洲及中国:仍限定为3岁及以上儿科患者。 未来或有望基于最新临床数据推动适用范围在全球更多地区的扩展。 总结:治疗低龄儿科患者的希望 司美替尼颗粒剂的获批为1岁及以上NF1相关PN儿科患者提供了新希望,以颗粒剂这一更易服用的剂型帮助低龄儿童从早期获得有效药物治疗。这一突破不仅为患者群体提供了更便捷的治疗方案,还进一步彰显了阿斯利康与默沙东在罕见病治疗领域的创新实力。
阿斯利康司美替尼口服颗粒剂获FDA批准 扩展适用人群至1岁及以上儿科患者 2025年9月10日,FDA官网公布,阿斯利康的司美替尼(selumetinib)口服颗粒剂获批上市,全面扩展适用人群至1岁及以上有症状且无法手术的1型神经纤维瘤病(NF1)相关丛状神经纤维瘤(PN)儿科患者。同时,司美替尼口服胶囊剂的适用年龄也同步扩大,从之前的2岁及以上扩展至1岁及以上儿科患者。这一批准标志着司美替尼在治疗NF1相关PN领域的适用范围进一步扩展,为更多低龄患者提供有效治疗方案。 司美替尼:MEK抑制剂的首个针对NF1相关疾病的获批药物 司美替尼是一款由Array BioPharma(辉瑞子公司)开发的丝裂原活化蛋白激酶激酶1和2(MEK1/2)抑制剂,商品名为Koselugo。该药物于2020年首次获批上市,是针对NF1相关丛状神经纤维瘤的首个药物治疗选择。司美替尼通过抑制MEK1/2信号通路活性,改善NF1相关PN的症状与病程。 阿斯利康于2003年从Array BioPharma处获得司美替尼全球权益,并于2017年与默沙东合作,共同推进该药在全球的开发及商业化。目前,司美替尼在多个国家已上市,其适用人群涵盖不同年龄段的NF1患者: 2020年 首次获批美国上市,适用于2岁及以上儿科患者; 2021年 获欧洲批准上市,适用范围为3岁及以上儿科患者; 2023年 在中国获批,适用范围与欧洲一致,为3岁及以上儿科患者。 批准依据:临床桥接及多项试验支持扩展适用人群 此次批准依据一系列研究数据,包括健康成人中的相对生物利用度桥接研究及多项针对儿科患者的临床试验: 桥接研究(Study 89):提供了司美替尼胶囊剂与颗粒剂在健康成人中的相对生物利用度数据,显示两种制剂的药物暴露量类似。 SPRINT和Stratum研究:这两项针对2岁及以上儿科患者的临床研究验证了司美替尼胶囊剂的有效性与安全性。 SPRINKLE研究:针对1岁及以上儿科患者的I/II期研究,进一步提供了司美替尼颗粒剂的有效性与耐受性数据。 这些研究共同支持适用人群的年龄外推至1岁及以上,并验证颗粒剂与胶囊剂在临床使用中的等效性。 安全性:包括更多儿科数据的更新 司美替尼的处方信息已更新警告和注意事项,涵盖更多儿科患者数据。这些包括: 心肌病 眼毒性 胃肠道毒性 皮肤毒性 肌酸磷酸激酶升高 出血风险增加(仅胶囊剂) 维生素E水平升高 胚胎毒性 FDA指出,目前未发现新的安全性信号,司美替尼在儿科患者中的安全性风险仍处于可控范围。 司美替尼的全球治疗覆盖 随着颗粒剂和胶囊剂的适用人群年龄扩展,司美替尼进一步巩固了其在NF1相关PN治疗领域的领导地位。然而,不同地区对司美替尼适合治疗年龄的规定仍有所不同: 美国:适用范围扩大至1岁及以上患者; 欧洲及中国:仍限定为3岁及以上儿科患者。 未来或有望基于最新临床数据推动适用范围在全球更多地区的扩展。 总结:治疗低龄儿科患者的希望 司美替尼颗粒剂的获批为1岁及以上NF1相关PN儿科患者提供了新希望,以颗粒剂这一更易服用的剂型帮助低龄儿童从早期获得有效药物治疗。这一突破不仅为患者群体提供了更便捷的治疗方案,还进一步彰显了阿斯利康与默沙东在罕见病治疗领域的创新实力。2025-09-18
-
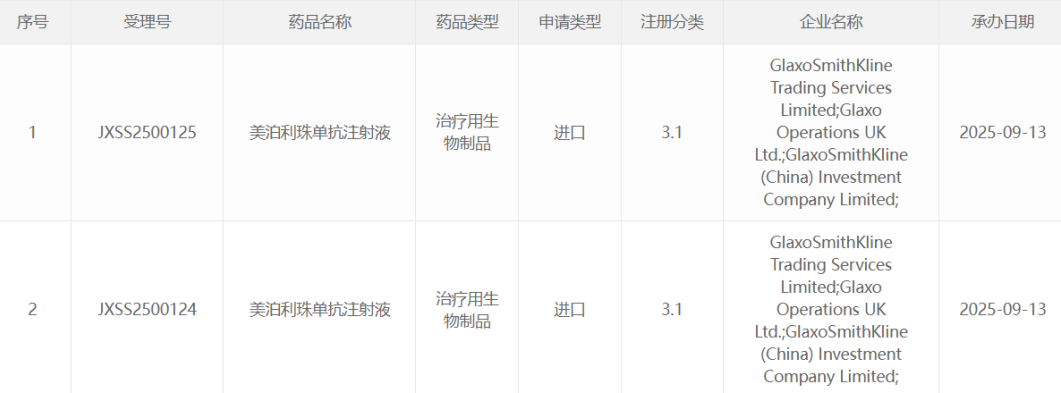 GSK美泊利珠单抗申报新适应症 或用于治疗COPD 2025年9月13日,国家药品监督管理局药品审评中心(CDE)网站显示,葛兰素史克(GSK)旗下全球首创的IL-5单抗美泊利珠单抗提交了新适应症的上市申请。据临床开发进度推测,此次申报的新适应症可能为慢性阻塞性肺病(COPD)。 美泊利珠单抗:IL-5单抗的先锋者 美泊利珠单抗是一款由GSK开发的全球首创IL-5单抗,每月一次的注射频率大大简化了患者的用药流程。2011年首次研发成功后,美泊利珠单抗已覆盖多项呼吸相关疾病: 2021年11月:首次在国内获批上市,用于治疗嗜酸性肉芽肿性多血管炎(EGPA)。 后续扩展:获批治疗嗜酸性粒细胞性重度哮喘和慢性鼻窦炎伴鼻息肉,为2型炎症相关疾病患者提供了更多选择。 COPD适应症:2型炎症患者的福音 慢性阻塞性肺病(COPD)是仅次于心血管疾病和癌症的全球第三大死亡原因,全球患者人数约为3.9亿。然而,这种疾病的诱因复杂,约40%的患者是由2型炎症反应推动,其特征是血嗜酸性粒细胞水平升高。对这种亚型患者的靶向治疗需求尚未完全满足。 今年5月,美泊利珠单抗已获美国FDA批准用于附加维持治疗嗜酸性粒细胞表型的COPD,成为首个获批COPD适应症的IL-5药物,也是COPD治疗领域的首个可每月给药的生物制剂。 III期MATINEE研究:验证疗效与安全性 美泊利珠单抗在COPD适应症的获批过程中,其临床疗效基于III期MATINEE研究的数据: 研究设计:一项多中心、随机、双盲安慰剂对照研究,招募806名中重度COPD患者。这些患者均存在以血嗜酸性粒细胞升高为特征的2型炎症并经历过疾病的频繁急性加重。 治疗方案:美泊利珠单抗每4周皮下注射100mg,作为维持治疗的附加方案。 研究终点:研究主要评估了中重度COPD年恶化率的减少情况。 关键结果: 治疗104周后,美泊利珠单抗组的年恶化率显著低于安慰剂组(0.80 vs 1.01,P=0.01),表明该药有效降低了COPD急性加重的发生频率。 同时,美泊利珠单抗的安全性表现良好,与既往适应症中的研究一致。 美泊利珠单抗国内进展 2021年,GSK在国内启动了美泊利珠单抗治疗嗜酸性粒细胞相关COPD的III期研究(CTR20210176),该研究于今年9月显示完成。这为此次新适应症的申报奠定了坚实数据基础。作为2型炎症COPD患者的一种重要选择,美泊利珠单抗有望帮助缓解疾病恶化、改善患者生活质量。 总结:美泊利珠单抗创新药物再升级 美泊利珠单抗的新适应症申报若能获批,意味着该药将在呼吸系统疾病治疗领域迈出重要一步,为COPD领域的2型炎症患者提供新的治疗选择。随着未来医疗需求的逐步扩大,这款每月一次给药的生物制剂,将进一步填补国内呼吸系统疾病靶向治疗的空白,为患者带来更多的希望。
GSK美泊利珠单抗申报新适应症 或用于治疗COPD 2025年9月13日,国家药品监督管理局药品审评中心(CDE)网站显示,葛兰素史克(GSK)旗下全球首创的IL-5单抗美泊利珠单抗提交了新适应症的上市申请。据临床开发进度推测,此次申报的新适应症可能为慢性阻塞性肺病(COPD)。 美泊利珠单抗:IL-5单抗的先锋者 美泊利珠单抗是一款由GSK开发的全球首创IL-5单抗,每月一次的注射频率大大简化了患者的用药流程。2011年首次研发成功后,美泊利珠单抗已覆盖多项呼吸相关疾病: 2021年11月:首次在国内获批上市,用于治疗嗜酸性肉芽肿性多血管炎(EGPA)。 后续扩展:获批治疗嗜酸性粒细胞性重度哮喘和慢性鼻窦炎伴鼻息肉,为2型炎症相关疾病患者提供了更多选择。 COPD适应症:2型炎症患者的福音 慢性阻塞性肺病(COPD)是仅次于心血管疾病和癌症的全球第三大死亡原因,全球患者人数约为3.9亿。然而,这种疾病的诱因复杂,约40%的患者是由2型炎症反应推动,其特征是血嗜酸性粒细胞水平升高。对这种亚型患者的靶向治疗需求尚未完全满足。 今年5月,美泊利珠单抗已获美国FDA批准用于附加维持治疗嗜酸性粒细胞表型的COPD,成为首个获批COPD适应症的IL-5药物,也是COPD治疗领域的首个可每月给药的生物制剂。 III期MATINEE研究:验证疗效与安全性 美泊利珠单抗在COPD适应症的获批过程中,其临床疗效基于III期MATINEE研究的数据: 研究设计:一项多中心、随机、双盲安慰剂对照研究,招募806名中重度COPD患者。这些患者均存在以血嗜酸性粒细胞升高为特征的2型炎症并经历过疾病的频繁急性加重。 治疗方案:美泊利珠单抗每4周皮下注射100mg,作为维持治疗的附加方案。 研究终点:研究主要评估了中重度COPD年恶化率的减少情况。 关键结果: 治疗104周后,美泊利珠单抗组的年恶化率显著低于安慰剂组(0.80 vs 1.01,P=0.01),表明该药有效降低了COPD急性加重的发生频率。 同时,美泊利珠单抗的安全性表现良好,与既往适应症中的研究一致。 美泊利珠单抗国内进展 2021年,GSK在国内启动了美泊利珠单抗治疗嗜酸性粒细胞相关COPD的III期研究(CTR20210176),该研究于今年9月显示完成。这为此次新适应症的申报奠定了坚实数据基础。作为2型炎症COPD患者的一种重要选择,美泊利珠单抗有望帮助缓解疾病恶化、改善患者生活质量。 总结:美泊利珠单抗创新药物再升级 美泊利珠单抗的新适应症申报若能获批,意味着该药将在呼吸系统疾病治疗领域迈出重要一步,为COPD领域的2型炎症患者提供新的治疗选择。随着未来医疗需求的逐步扩大,这款每月一次给药的生物制剂,将进一步填补国内呼吸系统疾病靶向治疗的空白,为患者带来更多的希望。2025-09-18
-
 民海生物Sabin株脊髓灰质炎灭活疫苗获批上市,助力预防急性传染病 2025年9月15日,国家药品监督管理局(NMPA)官网公示,民海生物自主研发的Sabin株脊髓灰质炎灭活疫苗(Vero细胞)正式获批上市。这款疫苗用于预防由脊髓灰质炎病毒(I型、II型和III型)感染引发的急性传染病,为脊髓灰质炎的防控提供了新的有效选择。 疫苗机制:通过刺激免疫系统抵御病毒 Sabin株脊髓灰质炎灭活疫苗(Vero细胞)通过刺激人体免疫系统,产生针对脊髓灰质炎病毒的免疫力,从而预防疾病的发生。该疫苗针对三种类型的脊髓灰质炎病毒(I型、II型和III型)均具有保护作用,是对抗这一急性传染病的重要防控手段。 注册性III期临床研究展示高效与安全 民海生物完成了一项针对2月龄健康婴儿的注册性III期临床研究。该试验采用随机、盲态、平行阳性对照的设计,评估了Sabin株脊髓灰质炎灭活疫苗(Vero细胞)与脊髓灰质炎减毒活疫苗序贯接种的安全性和有效性。这项研究的成功为疫苗的获批上市提供了强有力的临床数据支持。 脊髓灰质炎的防控意义 脊髓灰质炎是一种由脊髓灰质炎病毒感染引发的急性传染病,可导致严重的神经损伤乃至肢体瘫痪。虽然全球范围内脊髓灰质炎的流行得到了大幅控制,但疫苗接种仍是彻底消灭该疾病最关键的措施。Sabin株灭活疫苗的上市,为中国婴幼儿群体提供了更安全、更高效的免疫选择。 总结 民海生物的Sabin株脊髓灰质炎灭活疫苗(Vero细胞)通过成功开展III期临床试验并获批上市,展现了其对抗脊髓灰质炎的强大潜力。这一疫苗的推出将进一步强化我国脊髓灰质炎的疫苗接种体系,为全面保障儿童健康贡献力量。
民海生物Sabin株脊髓灰质炎灭活疫苗获批上市,助力预防急性传染病 2025年9月15日,国家药品监督管理局(NMPA)官网公示,民海生物自主研发的Sabin株脊髓灰质炎灭活疫苗(Vero细胞)正式获批上市。这款疫苗用于预防由脊髓灰质炎病毒(I型、II型和III型)感染引发的急性传染病,为脊髓灰质炎的防控提供了新的有效选择。 疫苗机制:通过刺激免疫系统抵御病毒 Sabin株脊髓灰质炎灭活疫苗(Vero细胞)通过刺激人体免疫系统,产生针对脊髓灰质炎病毒的免疫力,从而预防疾病的发生。该疫苗针对三种类型的脊髓灰质炎病毒(I型、II型和III型)均具有保护作用,是对抗这一急性传染病的重要防控手段。 注册性III期临床研究展示高效与安全 民海生物完成了一项针对2月龄健康婴儿的注册性III期临床研究。该试验采用随机、盲态、平行阳性对照的设计,评估了Sabin株脊髓灰质炎灭活疫苗(Vero细胞)与脊髓灰质炎减毒活疫苗序贯接种的安全性和有效性。这项研究的成功为疫苗的获批上市提供了强有力的临床数据支持。 脊髓灰质炎的防控意义 脊髓灰质炎是一种由脊髓灰质炎病毒感染引发的急性传染病,可导致严重的神经损伤乃至肢体瘫痪。虽然全球范围内脊髓灰质炎的流行得到了大幅控制,但疫苗接种仍是彻底消灭该疾病最关键的措施。Sabin株灭活疫苗的上市,为中国婴幼儿群体提供了更安全、更高效的免疫选择。 总结 民海生物的Sabin株脊髓灰质炎灭活疫苗(Vero细胞)通过成功开展III期临床试验并获批上市,展现了其对抗脊髓灰质炎的强大潜力。这一疫苗的推出将进一步强化我国脊髓灰质炎的疫苗接种体系,为全面保障儿童健康贡献力量。2025-09-17
大家都在看
-
1
荣灿生物获美国专利授权,助力mRNA药物研发新突破
-
2
罗伯医疗获批消化内镜手术机器人,填补国内技术空白
-
3
中国首个IGF-1R抗体药物获批上市,甲状腺眼病治疗迎来新曙光
-
4
广州润尔眼科盐酸依匹斯汀滴眼液获批上市,国内首仿迎来市场竞争新机遇
-
5
孤独症的早期识别与干预:帮助“星星的孩子”走向更好的未来
-
6
重大发现:朊病毒或成胶质母细胞瘤治疗新靶点
-
7
微型心脏起搏器的革新:为新生儿和儿童提供更安全的治疗
-
8
Bright Uro创新发布无导管尿动力学监测系统Glean,获FDA批准
-
9
华东医药司美格鲁肽申报上市,国产GLP-1迎来新突破
-
10
新发现:HDAC2-AS2长非编码RNA在肝细胞癌免疫逃逸中的关键作用
药品推荐
-

替格瑞洛 ticagrelor
适用于急性冠脉综合征患者,如不稳定性心绞痛、非ST段抬高心肌梗死或ST段抬高心肌梗死患者
英国阿斯利康
-

卡麦角林 Cabergoline
治疗帕金森、高催乳素血症及乳腺癌多巴胺D2受体激动剂
美国辉瑞公司(Pfizer Inc.)
-
纳武利尤单抗 Nivolumab
治疗转移性黑色素瘤肾癌肝癌等的免疫药,显著改善生存
美国百时美施贵宝公司(Bristol Myers Squibb)
-
urovaxom Escherichia coli Lysat
用于联合治疗和预防慢性尿路感染,特别是膀胱炎,本品主要用于治疗和预防4岁以上的反复尿路感染
瑞士OM Pharma
-

来那度胺 Lenalidomide
用于多发性骨髓瘤,淋巴瘤中位治疗持续时间延长
印度纳科Natco制药有限公司


