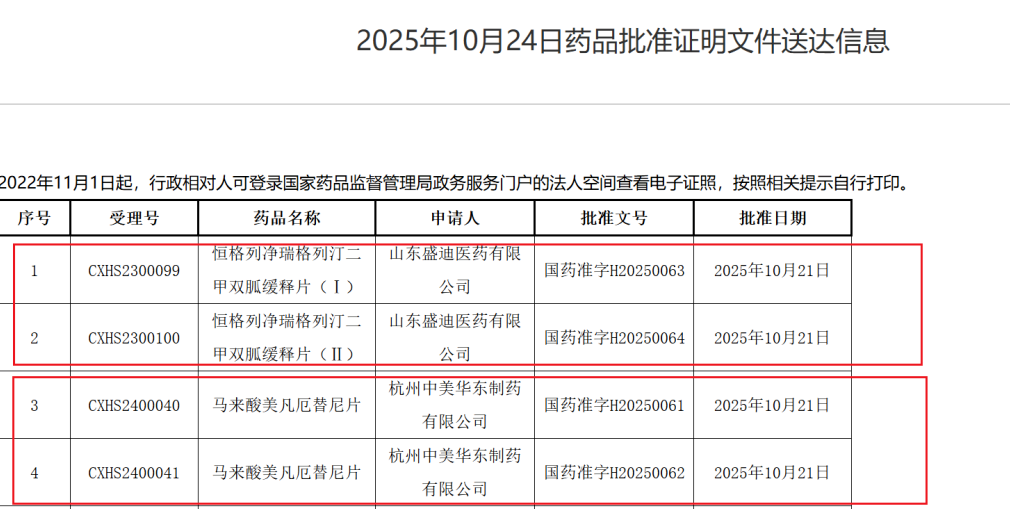
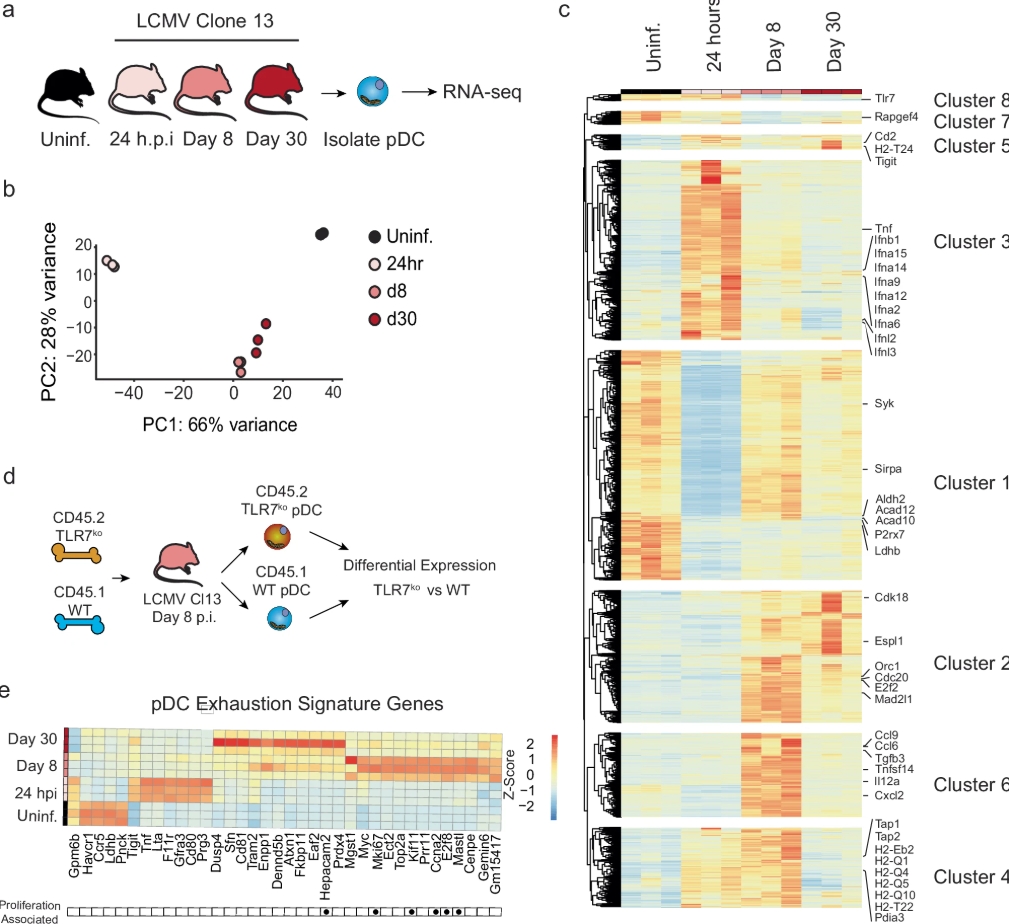
2025年8月2日,CDE(国家药品监督管理局药品审评中心)官网显示,诺华的基因疗法产品——Onasemnogene abeparvovec鞘内注射液(商品名:Zolgensma)已正式在中国申报上市,并被纳入优先审评。该药物旨在治疗6月龄及以上的5q型脊髓性肌萎缩症(SMA)患者,一旦获批,这将为中国SMA患者带来重磅治疗选择。

脊髓性肌萎缩症(SMA):婴幼儿遗传病头号威胁
SMA的疾病概述
SMA是2岁以下婴幼儿中最常见的遗传性致死性疾病之一。患者主要表现为全身肌肉萎缩和无力,逐渐丧失运动、吞咽甚至是呼吸功能,最终导致死亡。科学研究表明,SMA由SMN1基因和SMN2基因的功能丧失或突变导致。
治疗现状
传统SMA治疗手段通常侧重于延缓症状,但无法逆转疾病进展。Zolgensma作为一种基因疗法,通过直接修复缺陷基因,为患者提供从源头治疗的可能性。
Zolgensma:首个一次性基因疗法
FDA批准与国际应用
作为首个获得美国FDA批准用于治疗SMA的基因疗法,Zolgensma于2019年5月在美国上市,开启了现代基因替代疗法治疗遗传病的新篇章,其单次治疗费用定价高达212.5万美元,成为全球最昂贵药物之一。目前,该药物已在多个国家和地区上市,为数千名SMA患者带来福音。
治疗机制与技术优势
Zolgensma利用自身互补型腺相关病毒9(scAAV9)作为基因载体,通过单次静脉注射将拷贝的SMN1基因转移至患者体内。其主要优势包括:
靶向作用:通过腺相关病毒(AAV),基因能够安全高效地传递到颅神经与脊髓运动神经元,修复肌肉细胞功能;
一次性治疗:仅需单次输注即可实现长期的治疗效果;
持续产生关键蛋白:肌肉细胞持续表达全长SMN蛋白,恢复患者肌肉功能;
安全性较高:不整合至宿主基因组,避免潜在突变风险。
基因疗法的中国申报与市场前景
诺华加速在中国布局
随着Zolgensma申报上市,中国SMA患者有望获得全球领先的基因治疗方案。通过CDE优先审评,该药物有望更快获批,直接服务国内患者群体,填补中国基因疗法领域的空白。
SMA诊治需求迫切
在中国,SMA患者数量众多,但对先进治疗手段的可及性仍有较大不足。Zolgensma的上市不仅将改变传统治疗的格局,也将为基因疗法在更多遗传性致病领域的应用提供示范。
基因疗法的广阔应用与挑战
潜在扩展领域
Zolgensma的成功为腺相关病毒(AAV)载体的基因疗法开辟了新途径,未来有望推广至其他遗传性疾病,如杜氏肌营养不良以及其他神经退行性疾病领域。
成本与可及性挑战
虽然Zolgensma的治疗效果显著,但其高昂的治疗费用令部分患者望而却步,如何降低成本、提高医保覆盖率将是关键问题。
结语
诺华的重磅基因疗法Zolgensma在中国的申报上市,标志着中国基因疗法领域迈向新高度。这一一次性基因治疗的突破性疗法,有望将全球领先的医学创新带入中国市场,为SMA患者提供更高效、更长效的治疗选择。未来,随着基因疗法的技术进步与成本优化,更多患者有望从这一科学进步中获益,基因治疗在遗传病领域的应用也将进一步扩大,为医疗领域注入新的希望与活力。