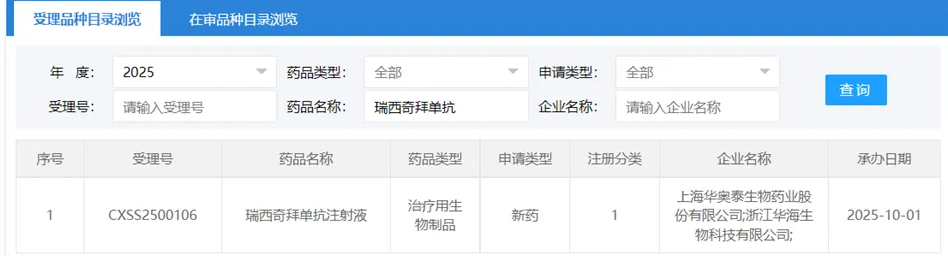
2025年10月1日,国家药品监督管理局药品审评中心(CDE)官网显示,华奥泰自主研发的1类创新药——瑞西奇拜单抗注射液的上市申请正式获受理。该药物于2025年8月被纳入优先审评,用于治疗成人泛发性脓疱型银屑病(GPP)急性发作。此外,瑞西奇拜单抗还曾获美国FDA授予治疗GPP的孤儿药资格。这款新药的推出,将为国内治疗这一罕见病带来重要突破。
GPP:病症特点与治疗需求
泛发性脓疱型银屑病(GPP)是一种罕见、可威胁生命的系统性中性粒细胞性皮肤病。其急性发作时,患者常出现全身红斑、脓疱,并伴有发热、关节痛、肌痛、C反应蛋白升高以及白细胞增多等系统性炎症症状。由于发作与死亡直接相关,若不及时控制病情,可能导致败血症和多系统器官衰竭,危及生命。因此,如何快速控制GPP急性发作成为治疗的关键。
2023年,GPP被纳入中国《第二批罕见病目录》。尽管病因和发病机制尚未完全明了,但研究表明,IL-36信号通路的过度激活是GPP发病的重要机制。靶向该通路的治疗药物因此成为潜在疗法。
瑞西奇拜单抗:靶向IL-36R的创新疗法
瑞西奇拜单抗(HB0034)是一款靶向IL-36R的IgG1型人源化单克隆抗体,由华奥泰自主研发。该药物通过精准阻断IL-36信号通路,有效抑制炎症因子的释放以及中性粒细胞的浸润,从而快速缓解GPP急性发作。
与目前已上市的治疗药物佩索利单抗(Spesolimab)相比,瑞西奇拜单抗的特点如下:
精准阻断IL-36R激活:通过抑制IL-36信号通路,从病理机制上控制GPP发作;
优先审评:药物创新性被认可,上市进程加速;
孤儿药资格:获FDA认证,为罕见病治疗领域的国际竞争力提供支持。
全球治疗现状:佩索利单抗的启示
目前,全球治疗GPP的药物中,仅有勃林格殷格翰的佩索利单抗获批。其通过特异性阻断IL-36R,抑制病理级联反应,为急性发作的患者提供了有效治疗。
佩索利单抗的市场布局:
静脉注射剂型:2022年12月被NMPA批准用于治疗成人GPP急性发作;
皮下注射剂型:2024年3月被NMPA批准用于减少12岁及以上青少年(体重≥40kg)以及成人患者的GPP发作。
佩索利单抗的临床应用为瑞西奇拜单抗的研发方向提供了重要参考,也展示了IL-36R靶向疗法的巨大潜力。
未来展望:瑞西奇拜单抗的临床意义
瑞西奇拜单抗作为国产创新药物,一旦获批上市,将填补国内在IL-36R抗体疗法领域的空白,为GPP患者提供新的治疗选择。以下为其潜在临床和市场意义:
提升治疗可及性:通过国产药物的研发与上市,降低患者的经济负担,扩大治疗覆盖范围;
推动罕见病创新:自主研发药物的成功经验,将加速国内罕见病治疗体系的完善;
国际市场竞争:借助孤儿药资格认证,瑞西奇拜单抗有望进军国际市场,与外资药物抗衡。
结语
随着华奥泰瑞西奇拜单抗上市申请的获受理,国内GPP治疗领域迎来了重要转折点。这款创新药物代表了国产企业在罕见病治疗中的技术突破,同时为GPP患者带来新的治疗希望。未来,随着上市进程的推进,瑞西奇拜单抗将为快速控制GPP急性发作提供更高效的解决方案,并进一步推动国产药物在国际舞台上的竞争力提升。