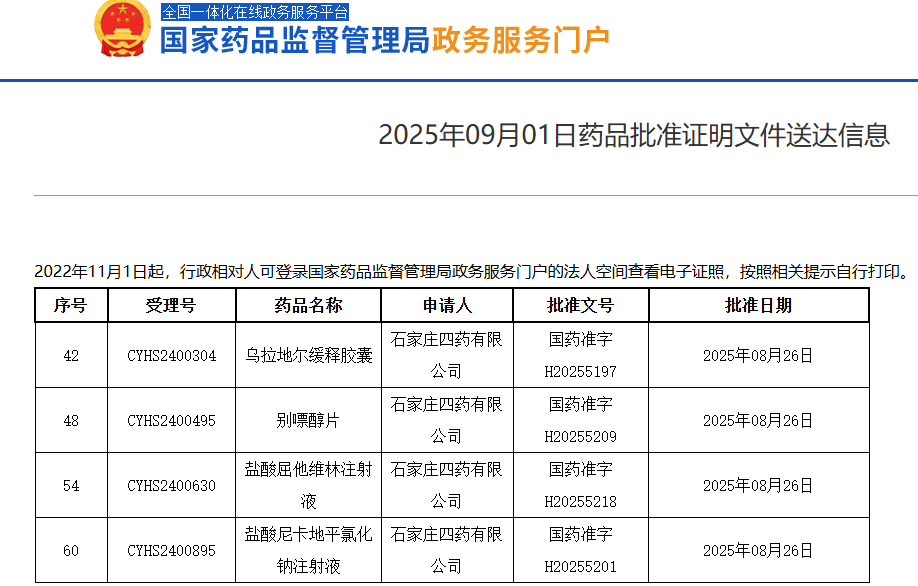
8月7日,礼来公司宣布其小分子GLP-1受体激动剂Orforglipron在治疗肥胖方面的III期临床试验ATTAIN-1研究获得了显著的临床数据,显示出较为理想的减重效果。

ATTAIN-1研究设计与受试者情况
ATTAIN-1研究是一项双盲、随机、安慰剂对照的III期临床试验,纳入了3127名没有糖尿病的肥胖或超重受试者。研究开始时,受试者的平均体重为103.2公斤,平均BMI为37.0 kg/m²。
减重效果显著
根据研究结果,Orforglipron治疗在第72周的减重效果显著。6mg、12mg和36mg剂量组的受试者体重分别减轻了7.8%、9.3%和12.4%,而安慰剂组则仅减轻了0.9%。此外,体重减少至少10%的受试者比例分别为35.9%、45.1%和59.6%,远高于安慰剂组的8.6%;体重减少至少15%的比例分别为16.5%、24.0%和39.6%,相比之下,安慰剂组这一比例为3.6%。
不同治疗方案下的减重数据
从治疗方案的角度来看,Orforglipron的效果同样令人瞩目。在第72周时,6mg、12mg和36mg剂量组分别减轻了7.5%、8.4%和11.2%的体重,而安慰剂组减轻了2.1%。在体重减少至少10%的比例上,6mg、12mg和36mg剂量组分别为33.3%、40.0%和54.6%,显著高于安慰剂组的12.9%。而体重减少15%以上的受试者比例为6mg、12mg和36mg组的15.1%、20.3%和36.0%,安慰剂组仅为5.9%。
安全性评估:胃肠不适较为常见
在安全性方面,最常见的不良事件为胃肠道反应,通常为轻度至中度。其中,6mg、12mg和36mg剂量组的受试者分别有28.9%、35.9%和33.7%经历了恶心,发生呕吐的比例为13.0%、21.4%和24.0%,而腹泻事件发生的比例分别为21.0%、22.8%和23.1%。相比之下,安慰剂组的相应比例较低。需要注意的是,6mg、12mg和36mg组分别有5.1%、7.7%和10.3%的受试者因不良事件中止治疗,远高于安慰剂组的2.6%。
总体治疗终止率与肝脏安全性
总体治疗终止率分别为6mg、12mg和36mg剂量组的21.9%、22.5%和24.4%,而安慰剂组为29.9%。幸运的是,研究未发现与肝脏相关的安全问题。
结论
礼来小分子GLP-1R激动剂Orforglipron在肥胖治疗方面展示了强劲的减重效果,并且安全性数据也较为可控。虽然胃肠道反应是最常见的不良事件,但大多数反应为轻度至中度,且没有发现显著的肝脏安全问题。因此,Orforglipron作为肥胖治疗的新选择,未来可能为广泛的超重或肥胖人群带来新的福音。