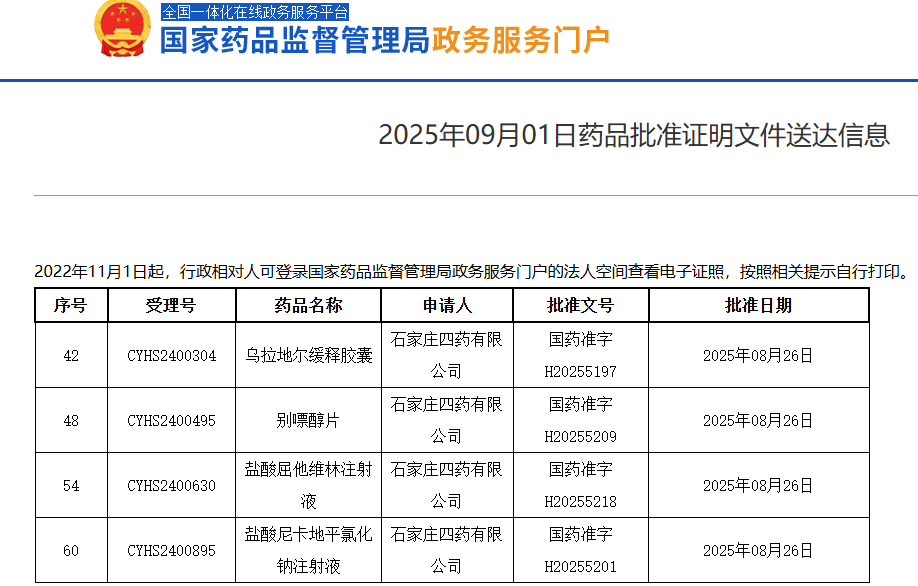
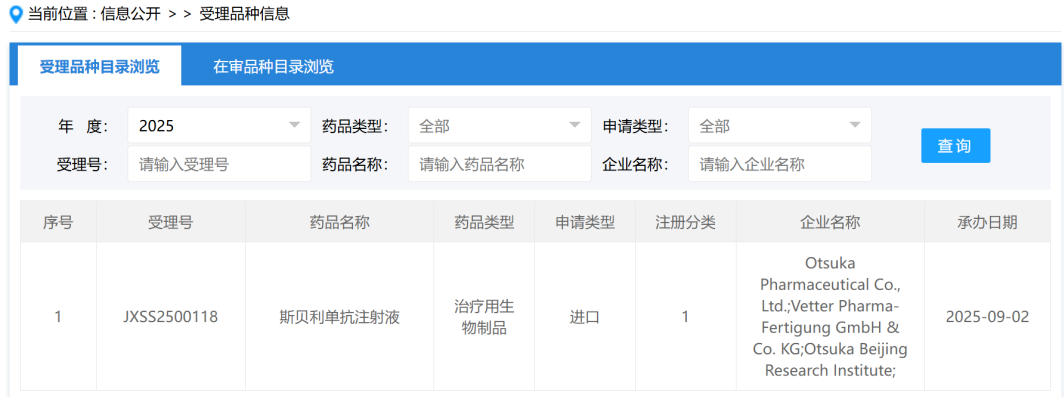
2025年9月1日,恒瑞医药宣布,HRS9531注射液的上市申请已获得国家药监局(NMPA)正式受理。该药物主要用于超重或肥胖成人的长期体重管理,特别是那些体重指数(BMI)≥28 kg/m²(肥胖)或BMI≥24 kg/m²(超重),并伴有至少一种体重相关并发症(如高血糖、高血压、血脂异常、脂肪肝等)的患者。

HRS9531:创新的双重受体激动剂
HRS9531是恒瑞医药自主研发的胰高血糖素样肽-1(GLP-1)和葡萄糖依赖性促胰岛素肽(GIP)双重受体激动剂。该药物旨在为超重、肥胖以及2型糖尿病等相关疾病提供一种新的治疗选择。根据目前的数据,HRS9531已在多项临床试验中展现出良好的疗效与安全性,至今已有超过2000名中国患者参与了试验。
临床试验:减重效果显著
今年7月,HRS9531注射液在中国开展的III期临床试验(HRS9531-301)取得了积极的顶线结果。在与安慰剂对比的试验中,HRS9531的各剂量组(2mg、4mg、6mg)在主要终点和关键次要终点上均表现优越。具体而言,该试验共招募了567名肥胖或超重患者,经过48周治疗,HRS9531注射液治疗组的平均体重减轻最大可达17.7%(安慰剂调整后为16.3%)。在高剂量组,44.4%的受试者体重下降超过20%。
安全性与耐受性:无严重不良反应
HRS9531在临床试验中表现出了良好的安全性和耐受性。大部分不良事件(TEAEs)为轻度至中度,主要集中在胃肠道反应方面。这与现有其他GLP-1类药物的疗效和安全性相当,且与HRS9531先前报道的Ⅱ期临床数据一致。
持续减重效果:Ⅱ期试验进一步验证
在Ⅱ期临床试验(NCT06054698)中,HRS9531注射液8mg剂量治疗36周后,受试者的体重平均减少了22.8%(安慰剂调整后为21.1%),并且未出现平台期现象,显示出较强的减重效果。补充分析显示,HRS9531 8mg治疗组的体重平均减少23.6%,显示了极为可观的减重潜力。
全球合作与未来展望
恒瑞医药已将HRS9531在大中华区以外地区的开发、生产和商业化独家权利授权给美国Kailera Therapeutics公司。Kailera将负责在全球范围内推进HRS9531的临床开发,并计划将其商业化,预计总额可达60亿美元。此外,恒瑞医药还获得Kailera19.9%的股权。
随着临床数据的不断更新和全球市场的拓展,HRS9531注射液在治疗超重、肥胖及其并发症方面有望成为一个重要的治疗选项。预计这一创新药物将对体重管理领域产生深远影响,并为全球患者带来更多的治疗希望。
总结:新疗法带来的希望
HRS9531注射液的上市申请获得受理,为治疗超重和肥胖带来了新的可能性。随着临床试验结果的不断确认,这一创新药物有望成为体重管理领域的一项突破,进一步推动全球超重和肥胖治疗的进展。