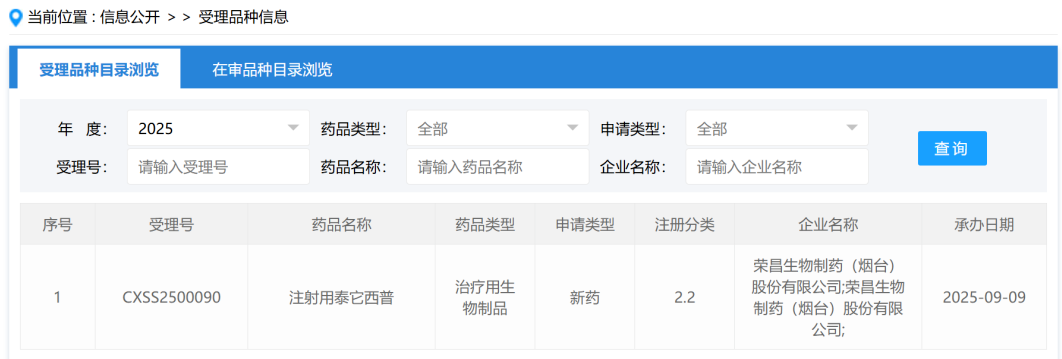
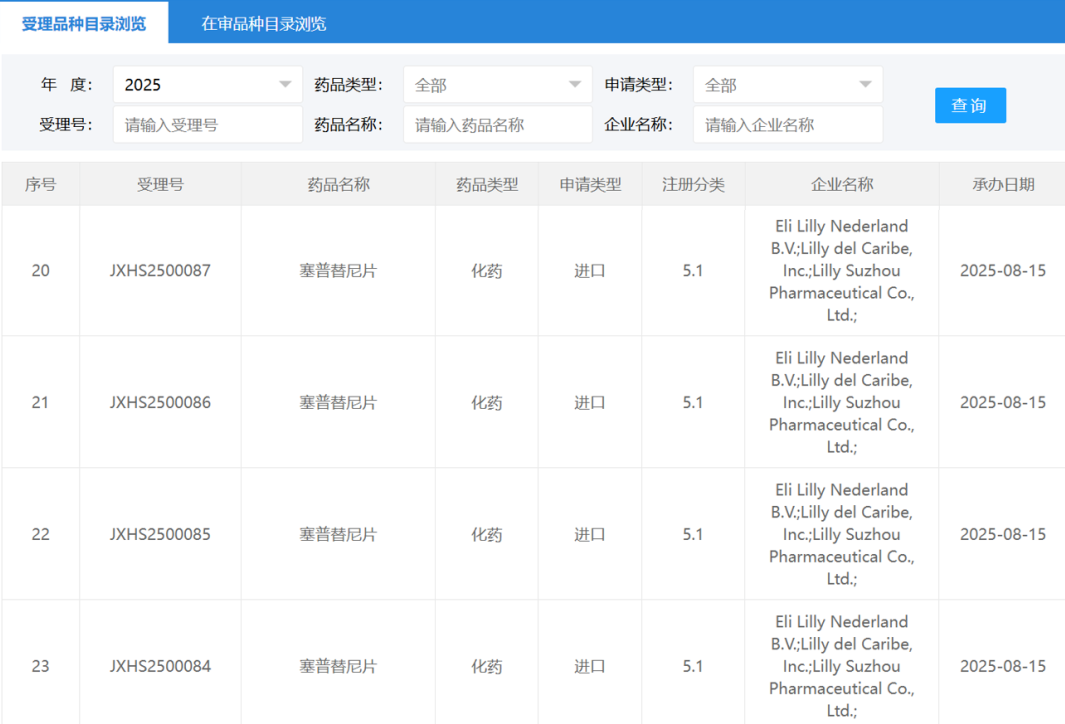
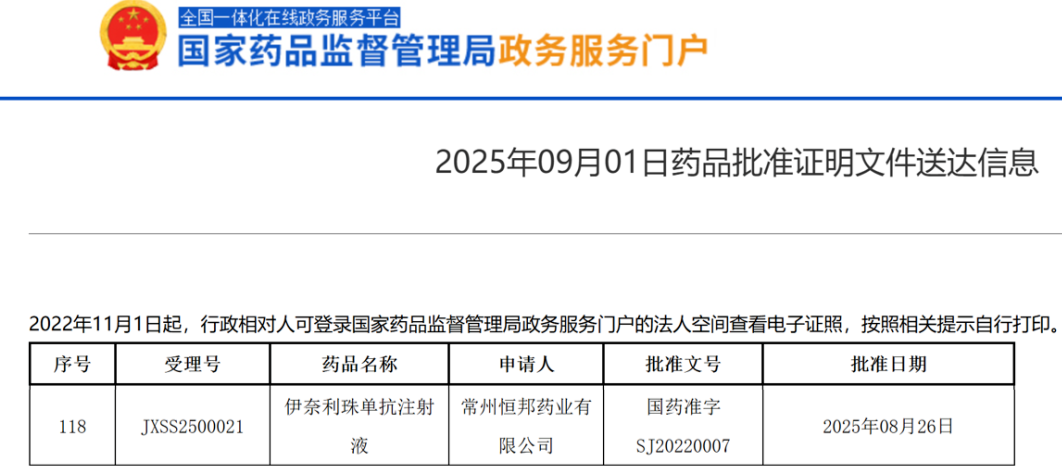
2025年9月1日,翰森制药旗下子公司常州恒邦药业宣布,其开发的伊奈利珠单抗(inebilizumab)获得国家药监局(NMPA)批准,新增适应症为治疗免疫球蛋白G4相关疾病(IgG4-RD)成人患者。这一批准使得伊奈利珠单抗成为全球首个获批用于治疗IgG4-RD的药物,标志着该药物在自身免疫性疾病领域的应用拓展。
伊奈利珠单抗:抗CD19单抗的创新突破
伊奈利珠单抗是一种抗CD19单克隆抗体,最初由Viela Bio开发,后被Horizon公司收购(2021年),Horizon公司于2023年被安进(Amgen)收购。该药物于2020年6月首次在美国获得批准,用于治疗抗水通道蛋白4(AQP4)抗体阳性的视神经脊髓炎谱系障碍(NMOSD)成人患者,并在2022年3月获得中国批准。翰森制药自2019年起与Viela Bio达成合作协议,获得该药物在中国地区的开发和商业化权益。
III期MITIGATE研究:伊奈利珠单抗显著降低IgG4-RD发作风险
伊奈利珠单抗在治疗IgG4-RD方面的研究取得了积极成果。2024年6月,伊奈利珠单抗治疗IgG4-RD的III期临床试验(MITIGATE研究)取得了令人鼓舞的结果。MITIGATE研究是一项多中心、随机、双盲、安慰剂对照的临床试验,共纳入160名患者,旨在评估伊奈利珠单抗(300mg,静脉注射)对比安慰剂在IgG4-RD患者中的疗效和安全性。
研究结果显示,在为期52周的治疗期内,伊奈利珠单抗组的患者IgG4-RD发作风险相比安慰剂组降低了87%(HR=0.13,p<0.0001)。此外,研究还达成了所有关键次要终点,包括年化发作率、完全缓解率(无发作、免治疗)。在安全性方面,未出现新的安全性信号,表明伊奈利珠单抗在该适应症中的应用是安全的。
IgG4-RD:一种严重的免疫介导性疾病
IgG4相关疾病(IgG4-RD)是一种慢性、全身性、免疫介导的纤维化性炎症性疾病,通常影响多个器官,并可能导致器官的不可逆损伤。根据估计,IgG4-RD的发病率约为每10万人中1至5例。研究发现,CD19阳性B细胞在IgG4-RD的发病机制中扮演重要角色,它们通过驱动炎症和纤维化过程,并与其他免疫细胞互动,促进疾病的进展。
目前,全球仅有伊奈利珠单抗和obexelimab正在进行IgG4-RD的III期临床研究,这也进一步证明了伊奈利珠单抗在治疗IgG4-RD方面的重要性和创新性。
总结:伊奈利珠单抗为IgG4-RD患者带来新希望
伊奈利珠单抗的批准,不仅为IgG4-RD患者提供了一种全新的治疗选择,也为自免性疾病的治疗带来了突破性的进展。凭借其在III期临床研究中取得的优异效果,伊奈利珠单抗无疑将成为IgG4-RD治疗领域的重要药物。随着后续数据的进一步积累,预计该药物将在全球范围内为更多患者带来福音。