随着全球癌症病例不断增加,2023年新增癌症病例已超过2000万,前列腺癌、乳腺癌以及神经胶质瘤成为男性、女性及神经系统肿瘤中最为常见的疾病类型。尽管传统的组织活检是癌症诊断的重要手段,但由于其具有侵入性,并且无法动态监测转移性癌症的变化,越来越多的研究开始关注液体活检技术。液体活检以其无创、可重复的优点,正在成为癌症早期筛查和监测的重要工具。然而,现有技术如对循环肿瘤DNA(ctDNA)的检测,其灵敏度在早期癌症中的检测率仅为50%-70%,且无法精准反映肿瘤微环境的变化。
近期,西达赛奈医学中心等研究机构在《Cell Reports Medicine》期刊上发表的研究显示,细胞外囊泡(EVs)特别是大型原癌小体(LOs),成为液体活检领域的潜在“黄金标记物”,为癌症诊断带来了一项突破。

大型原癌小体(LOs):癌症诊断的新“分子集装箱”
细胞外囊泡,尤其是直径大于1微米的LOs,因其富含蛋白质、RNA和DNA,被认为是癌症诊断的“分子集装箱”。这些囊泡在血液中的浓度与癌症患者的转移灶负荷密切相关。研究发现,晚期前列腺癌患者的血液中LOs的数量是健康人的30倍,且这一指标与癌症的转移灶负荷呈正相关。
然而,由于传统的分离方法,如超速离心,容易将LOs丢弃,因此这些囊泡的临床价值一直未被充分研究。该项新研究优化了LOs的分离流程,为其在癌症诊断中的应用打开了新的大门。
创新分离技术:提升LOs回收率三倍
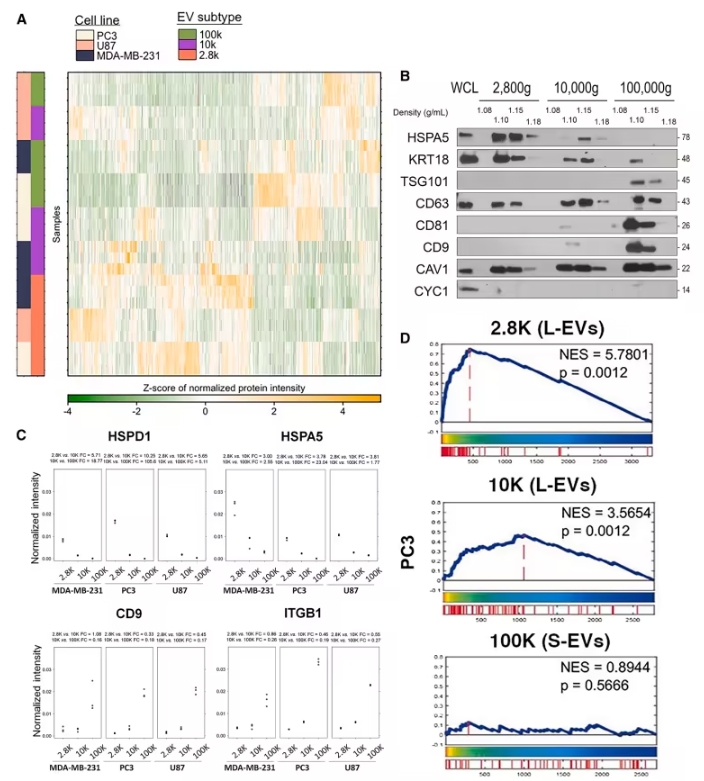
研究团队通过改进分离技术,成功将LOs的回收率提升了三倍。采用低速离心(2,800g)进行分离,LOs主要富集在这一组分,而非传统的中速离心(10,000g)组分。通过这一新方法,研究人员不仅能够提高LOs的回收效率,还能获得更多具有诊断价值的分子信息。
在研究过程中,研究人员将前列腺癌(PC3)、胶质瘤(U87)、乳腺癌(MDA-MB-231)等细胞系的EVs与20例转移性前列腺癌患者血浆样本进行对比,首次构建了LOs蛋白质与转录组的联合图谱,揭示了LOs在癌症诊断中的独特潜力。
LOs的三重价值:新型生物标志物、代谢异常“分子哨兵”与耐药监测
该研究为LOs的临床应用提供了强有力的证据。具体来说,研究揭示了LOs在癌症监测中的三重价值:
新型生物标志物
LOs富含线粒体成分,尤其是与能量代谢异常相关的分子,如MT-CO1等,具有作为代谢异常的“分子哨兵”的潜力。研究还发现,LOs表面蛋白与激素治疗耐药的发生密切相关,特别是在前列腺癌和乳腺癌患者中。
为稀有细胞外囊泡亚群分析建立新范式
该研究证明,LOs作为细胞外囊泡的重要亚群,其在癌症早期诊断和动态监测中的应用前景广阔。通过优化的分离技术,研究人员能够更高效地捕捉到这一微小而重要的囊泡,为未来的临床应用提供了可靠的数据支持。
动态监测耐药演变
研究表明,LOs中的39种表面蛋白(如CD44、CD9)与激素治疗耐药性密切相关。特别是CD44高表达的患者,其无进展生存期显著缩短,为耐药性变异的动态监测提供了新的工具。
LOs与癌症监测:未来可期
通过对LOs的深入研究,科学家们不仅揭示了其作为癌症诊断和监测标志物的巨大潜力,还为液体活检提供了一种新的思路。研究人员表示,未来可以通过基于LOs表面标志物的免疫捕获技术,使LOs检测成为临床常规诊断项目。进一步的研究也将探索LOs的细胞来源机制及其与循环肿瘤细胞(CTC)联合诊断的价值。
在动物模型实验中,研究团队还发现,抑制LOs关键酶DDHD2能够显著延缓肿瘤转移。这一发现为LOs作为治疗靶点提供了新的方向。
总结:LOs带来癌症诊断的革命性进展
这项研究打破了传统“细胞外囊泡越小越有价值”的认知,展示了LOs作为癌症液体活检标志物的独特优势。通过优化的分离流程和多组学技术,LOs为代谢异常肿瘤提供了新型生物标志物,为癌症耐药演变的动态监测开辟了新天地。未来,LOs检测有望成为癌症早期筛查和转移监测的重要手段,为患者带来更多希望。