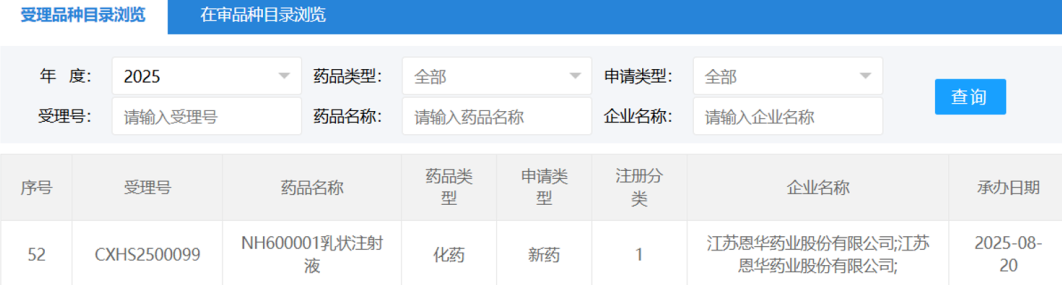
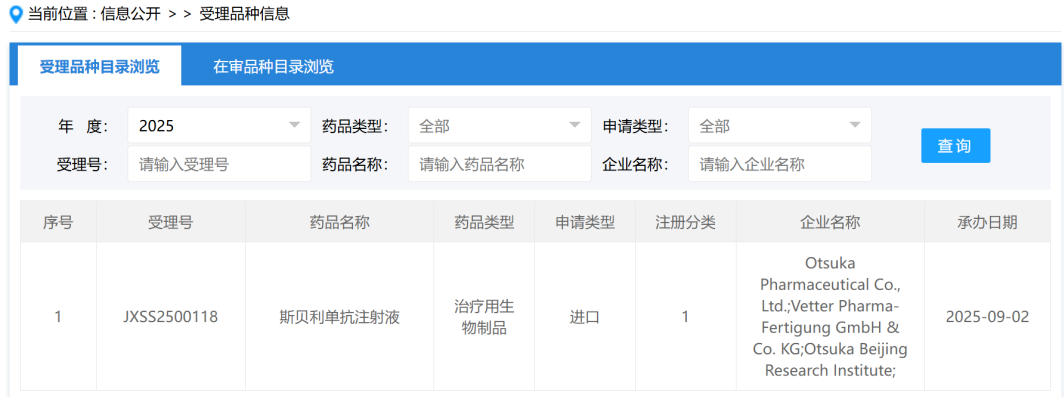
近日,CDE官网显示,大冢制药的斯贝利单抗(Sibeprenlimab)已经向中国药监部门提交了上市申请,目标是治疗成人原发性免疫球蛋白A肾病(IgA肾病)患者,以维持其肾脏功能。值得注意的是,斯贝利单抗已于2023年3月在美国递交上市申请,并且在5月获得了优先审评,预计PDUFA日期为2025年11月28日。
斯贝利单抗:靶向APRIL的单抗药物
斯贝利单抗是由Visterra公司开发的抗APRIL单抗。APRIL是肿瘤坏死因子(TNF)家族中的一种细胞因子,在免疫反应和免疫疾病中发挥重要作用。APRIL在IgA肾病的“四重打击”机制中起着关键作用,主要通过促进致病性半乳糖缺陷型IgA1(Gd-IgA1)抗体的产生以及免疫复合物的形成,推动IgA肾病的进展。斯贝利单抗通过靶向并抑制APRIL,进而减缓IgA肾病的进展,为患者提供了新的治疗选择。
临床试验证明疗效显著
斯贝利单抗在IgA肾病中的疗效已在多个临床研究中得到验证。II期ENVISION研究和III期VISIONARY研究分别评估了斯贝利单抗治疗IgA肾病的效果。
ENVISION研究(n=155)显示,在治疗第12个月,接受斯贝利单抗治疗的患者在尿蛋白肌酐比值(UPCR)和肾小球滤过率(eGFR)方面均有显著改善。具体来看,接受不同剂量(2/4/8mg/kg)的患者,UPCR分别降低了47.2%、58.8%、62.0%,而eGFR变化相对较小,表明该药物对肾脏功能具有保护作用。
VISIONARY研究(n=510)则进一步证明,在治疗9个月后,斯贝利单抗组患者的24小时尿蛋白肌酐比值(UPCR)较基线下降了51.2%(P<0.0001)。当前该研究仍在进行,预计将在2026年初完成对第24个月患者年化eGFR变化的评估。
良好的安全性表现
斯贝利单抗在治疗过程中的安全性良好,研究数据与之前的报告一致。具体来说,斯贝利单抗组和安慰剂组的治疗期间不良事件(TEAE)发生率分别为76.3%和84.5%,而出现严重不良事件的比例则分别为3.9%和5.4%。这些数据表明,斯贝利单抗的副作用较为可控,为临床应用提供了安全性保障。
IgA肾病的挑战与现有治疗方案
IgA肾病是一种进展性慢性肾脏病,通常发病年龄在20到40岁之间。它的特点是Gd-IgA1免疫复合物在肾脏中的积累,逐步导致肾功能丧失,最终可能发展为终末期肾病(ESKD)。目前,全球已有几款药物获批用于治疗IgA肾病,包括:
Nefecon(胶囊,16mg,每日1次)
司帕生坦(片剂,200/400mg,每日1次)
伊普可泮(胶囊,200mg,每日2次)
阿曲生坦(片剂,0.75mg,每日1次)
然而,斯贝利单抗作为首款APRIL靶向单抗药物,填补了该领域的空白,为IgA肾病患者提供了新治疗选择。值得一提的是,诺华公司目前也在开发一款名为Zigakibart的APRIL单抗,正在进行III期临床试验,预计用药频率为每两周一次。
未来展望
随着斯贝利单抗在中国的上市申请的推进,以及美国即将迎来上市审查的关键时间点,这款药物有望成为IgA肾病治疗的新突破口。通过靶向APRIL,斯贝利单抗为治疗这一慢性、自身免疫性肾脏疾病提供了新的治疗思路和解决方案。对于IgA肾病患者,尤其是处于疾病进展中的患者,斯贝利单抗可能为他们带来新的希望。