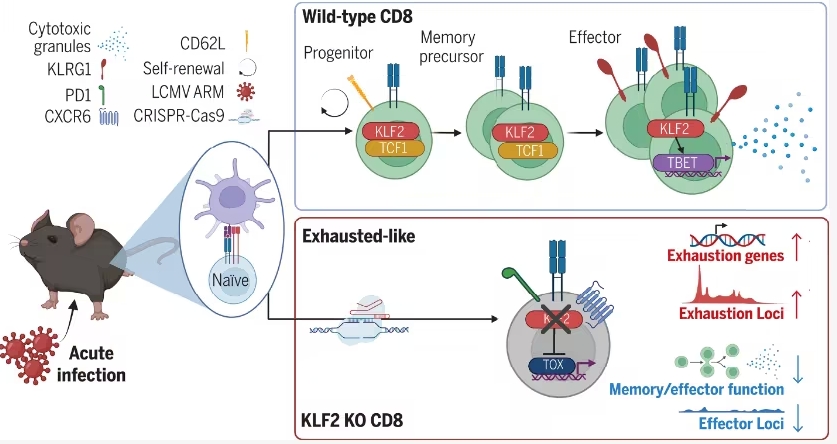
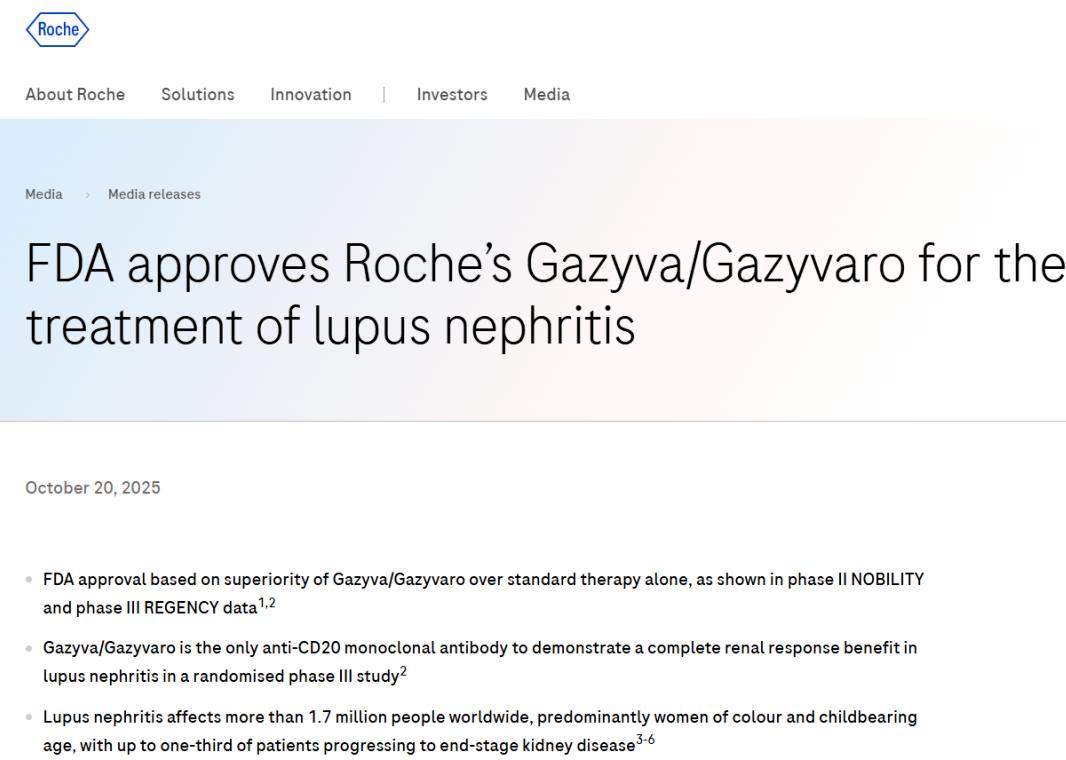
10月20日,罗氏宣布,其创新药物奥妥珠单抗(Gazyva/Gazyvaro)正式获得美国食品药品监督管理局(FDA)批准新适应症,用于治疗接受标准方案治疗的活动性狼疮性肾炎(LN)成年患者。值得关注的是,在首年完成四次初始治疗后,患者未来的维持治疗频率可调整为每年仅两次,这将极大减轻治疗负担。至此,奥妥珠单抗成为首款获FDA批准用于狼疮性肾炎的CD20靶向疗法。
临床数据支撑:III期REGENCY研究结果令人振奋
此次批准的依据来自于II期NOBILITY研究及关键性III期REGENCY研究的临床成果。研究显示,奥妥珠单抗联合标准治疗(霉酚酸酯与糖皮质激素)的患者在第76周时,完全肾脏缓解(CRR)率达46.4%,显著高于单用标准治疗的33.1%。经统计学调整后,差异达到13.4%(95% CI:2.0%-24.8%;P=0.0232),差异具有统计学意义。
此外,奥妥珠单抗组在补体水平改善、抗双链DNA抗体降低、疾病活动度控制及炎症标志物减少等方面均表现出显著临床优势。研究团队指出,这是首款在随机III期试验中证实能显著提高CRR率的CD20单抗药物。
机制独特:第三代Fc改良CD20抗体再显潜力
奥妥珠单抗属于第三代经Fc段优化的II型人源化CD20单抗,于2013年首次获批上市。其结构设计能更有效诱导靶细胞死亡,并减少抗体依赖性细胞毒性(ADCC)反应带来的副作用。目前,该药已被批准用于治疗三类血液系统恶性肿瘤——慢性淋巴细胞白血病(CLL)、滤泡性淋巴瘤(FL)及小淋巴细胞性淋巴瘤(SLL)。
此次扩展至自身免疫性疾病领域,标志着奥妥珠单抗的治疗版图正从肿瘤领域迈向免疫调控治疗新阶段。
狼疮性肾炎:影响全球170万患者的隐形威胁
系统性红斑狼疮(SLE)是一种慢性自身免疫疾病,而狼疮性肾炎(LN)则是其最严重的并发症之一。据统计,全球约有170万名患者受到LN困扰,其中女性为主要受影响人群,尤其以有色人种及育龄妇女最为多见。若病情控制不佳,多达三分之一的患者可能发展为终末期肾病(ESRD),最终需依赖透析或肾移植维持生命。
奥妥珠单抗的批准,为这一高风险群体提供了新的希望。通过精准靶向B细胞的CD20分子,它能有效清除异常活化的B细胞,从而减少免疫系统对自身组织的攻击。
结语:免疫治疗时代,狼疮性肾炎迎来新拐点
奥妥珠单抗获批新适应症,标志着狼疮性肾炎治疗迈入“靶向免疫”新时代。它不仅拓展了CD20单抗的应用边界,也为患者带来了更高缓解率、更长缓解期及更便捷的治疗方案。未来,随着更多后续研究的推进,奥妥珠单抗有望成为LN治疗的核心药物之一,为全球数百万患者带来新的生机。