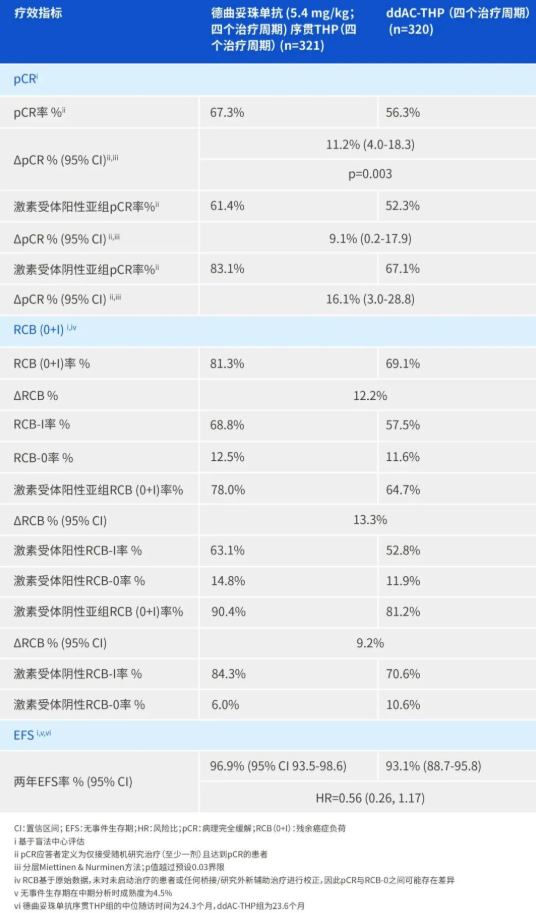
2025年9月29日,在美国天然产品协会(NPA)的持续努力下,美国食品药品监督管理局(FDA)最终改变态度,正式确认β-烟酰胺单核苷酸(NMN)可以合法用于膳食补充剂。这一决定标志着NMN在美国市场的合规问题终于迎来突破,预计将推动全球市场的进一步发展。
尚科生物NMN的认证历程
尚科生物的NMN产品在2022年5月获得了美国新膳食补充剂成分认证(NDI,编号1247)。然而,同年11月,FDA曾因“NMN不符合膳食补充剂定义”而撤回该认证。此举引发了行业的广泛关注与不满。经过NPA的持续抗议和法律诉讼,FDA在2024年8月承认,早在2017年NMN就已在美国市场作为膳食补充剂销售,因此具有合法性。
NPA的法律行动对FDA立场的影响
NPA不仅针对NMN问题向FDA提交了公民请愿书,还提起了联邦诉讼,促使FDA重新审视其立场。实际上,这并非FDA首次在行业协会的法律挑战下调整政策。2022年,NPA曾成功推动FDA修改了关于NAC(N-乙酰-L-半胱氨酸)的政策,允许相关产品重新上市。可以看出,NPA的法律行动在推动食品补充剂法规方面具有显著影响。
尚科生物NMN的生产和国际认证
尚科生物的NMN产品符合GMP生产标准,并且其生产基地位于浙江,覆盖230亩土地,拥有高达100吨/年的NMN产能。此外,尚科生物的NMN不仅获得了美国NDI认证,还在推进欧盟Novel Food申请及澳大利亚TGA认证,进一步扩展了国际市场的影响力。
全球市场前景:NMN从争议到主流
FDA的最新决定无疑为NMN的全球市场开辟了新的发展空间。随着FDA确认NMN合法性,原本因合规问题而面临困境的NMN,逐渐从“争议成分”转变为“主流原料”。这一转变将推动NMN在全球膳食补充剂市场的普及,尤其是在欧美及亚太地区,预计将吸引更多投资与研发关注。
结语:NMN迎来合规新阶段
随着FDA立场的改变和尚科生物等企业的努力,NMN的全球合规问题得到有效解决。未来,NMN将有望成为膳食补充剂行业中的重要原料,带动相关产品在全球范围内的销售和市场渗透。这一变革也为消费者提供了更多健康选择,助力NMN市场的快速扩展。