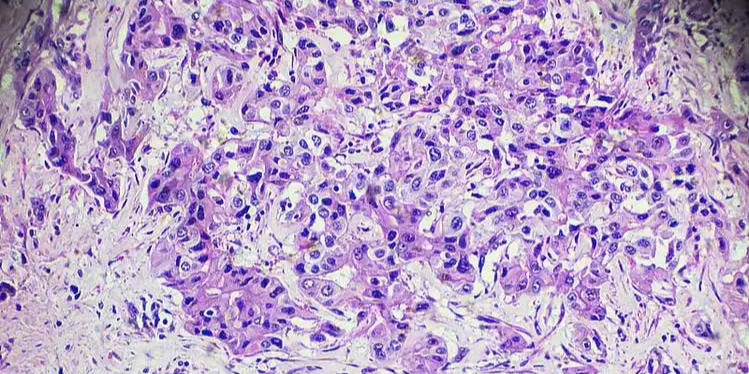
8月20日,国家药品监督管理局药品审评中心(CDE)官网披露,石药集团的HER2双抗药物 安尼妥单抗(KN026,anbenitamab) 正拟纳入优先审评。这一消息标志着国产创新药物在抗HER2领域的又一突破,旨在为治疗 HER2阳性局部晚期、复发或转移性胃/胃-食管结合部腺癌 患者提供全新治疗选择。

治疗背景:HER2阳性胃癌领域的新希望
安尼妥单抗拟申请的适应症为联合化疗,用于治疗 至少接受过一种系统性治疗失败的HER2阳性胃癌患者。这些治疗必须包括曲妥珠单抗联合化疗等标准方案。然而,对于晚期胃癌患者而言,在现有疗法失败后,疗效更优、耐受性更好的治疗方案一直是亟待解决的临床需求。
双结合表位:突破性的抗癌机制
安尼妥单抗最初由康宁杰瑞公司开发,具有优异的创新机制。该药通过 同时结合HER2的两个非重叠表位(靶点位点),能够阻断HER2信号的传递,从而更有效地抑制癌细胞的生长。相比于 曲妥珠单抗和帕妥珠单抗联合用药,安尼妥单抗展现出更优的抗肿瘤效果。
2021年8月,石药集团获得了安尼妥单抗在中国的独家开发与商业化权益,此后展开了针对胃癌领域的多项临床研究。
临床研究进展:显著疗效初露锋芒
今年5月,安尼妥单抗在中国开展的关键性II/III期临床研究(KC-WISE)传来利好消息。研究数据显示,该药针对二线治疗胃癌的 主要终点中位无进展生存期(PFS)显著延长,相较于单纯化疗组患者表现出更加优秀的疗效。尽管具体详细数据尚未公开,但这一结果已证实了其潜在的突破性治疗价值。
以患者需求为核心:优先审评的意义
此次拟被纳入优先审评名单,反映了国家对 满足迫切临床需求药物 的高度重视。安尼妥单抗不仅代表了中国创新药的技术领先性,也满足了临床治疗 HER2阳性胃癌 的未被满足需求。优先审评将加速这一药物在国内上市的进程,为更多晚期胃癌患者带来生存希望。
审评与展望:推动国产双抗药物发展
石药集团HER2双抗安尼妥单抗的研发与商业化,展现了我国生物医药领域在创新药物开发上的进步。从最早期的引进到本地化商业化,再到展开全面临床研究,石药集团正以实际行动推动国产创新药物走向国际前沿。
未来,随着安尼妥单抗更多研究数据的公布以及后续市场应用扩大,它有望为国内外晚期HER2阳性胃癌患者提供新的治疗可能,同时进一步提升国产创新药在全球市场的竞争力。
总结:开启晚期胃癌治疗新篇章
从独特的双结合表位机制到突破性临床疗效,石药集团的HER2双抗安尼妥单抗的拟优先审评,标志着国产创新药物在抗HER2领域的新突破。它不仅满足了临床未解决的需求,也为晚期胃癌治疗打开了新的希望之门。通过国家支持、企业推动和持续研发,国产创新药的未来充满潜力与机遇。