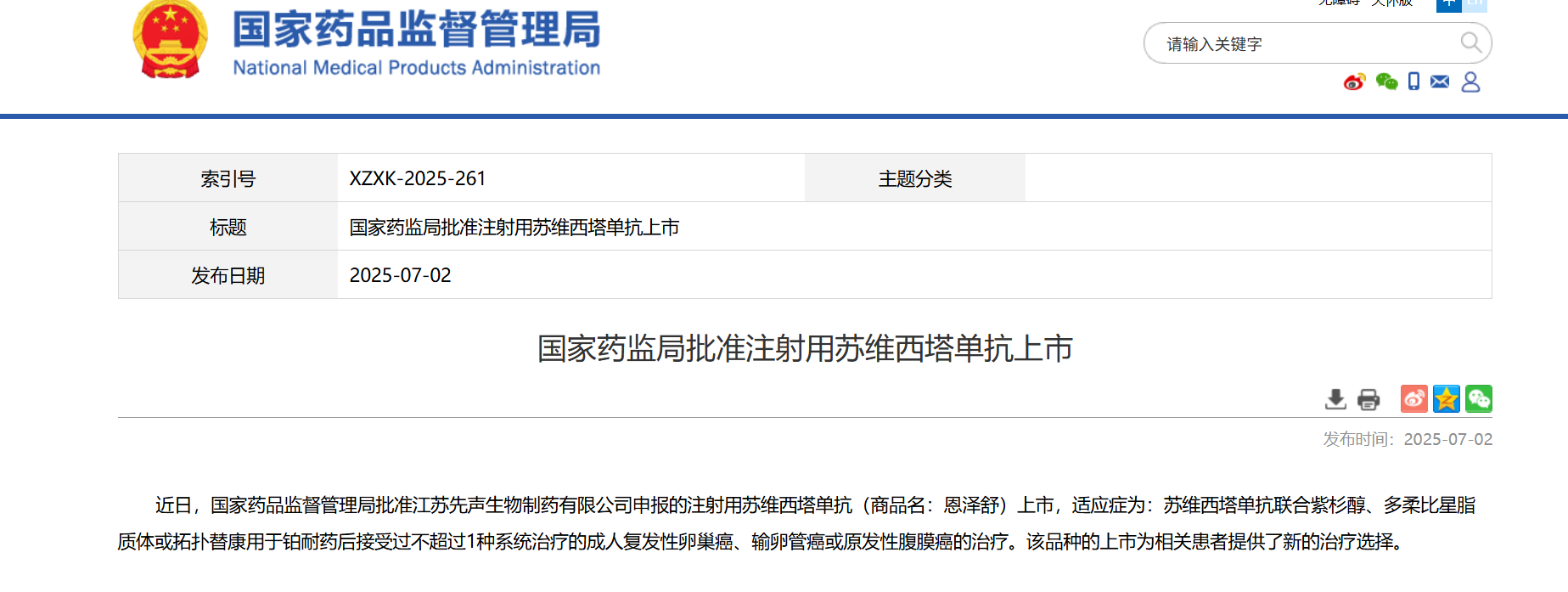
2025年7月3日,先声药业集团旗下创新药子公司——先声再明宣布,其新一代VEGF靶向抗体药物——恩泽舒®(苏维西塔单抗)已获得国家药监局批准上市(批准文号:国药准字S20250037,批准日期:2025年6月30日),成为国内首个覆盖铂耐药卵巢癌全人群的靶向治疗药物。这款药物为联合化疗治疗铂耐药复发性卵巢癌、输卵管癌或原发性腹膜癌患者提供了新的治疗选择,填补了这一领域的临床空白。值得一提的是,苏维西塔单抗是先声药业在2025年继达利雷生之后,推出的第二款创新药。
突破性生存获益,解决铂耐药卵巢癌治疗难题
恩泽舒®的获批基于全球首个证实血管靶向药物对铂耐药卵巢癌患者总生存期(OS)具有显著改善的Ⅲ期临床研究(SCORES)。该研究由中国医学科学院肿瘤医院的吴令英教授领导,涵盖了421例铂耐药卵巢癌患者,其中约50%的患者曾接受抗VEGF和PARP抑制剂治疗。研究数据显示,苏维西塔单抗显著延长了患者的无进展生存期(PFS),从对照组的2.73个月提升至5.49个月(HR=0.46,P<0.0001),并且总生存期(OS)也获得了显著提高,死亡风险降低23%(HR=0.77,P=0.0304)。此外,所有临床亚组(包括不同治疗线、铂间期及既往抗VEGF治疗情况等)均显示一致的治疗获益。
填补临床空白,提供新的治疗选择
卵巢癌是女性恶性肿瘤中死亡率最高的类型。据2024年国家癌症中心统计,我国年新发卵巢癌病例约6.11万例,死亡病例超过3万。尽管传统的治疗方式以含铂化疗为主,但多数卵巢癌患者在治疗后会复发并变为铂耐药,这些患者的治疗选择十分有限,且预后较差。此前,中国尚无针对铂耐药卵巢癌的有效靶向药物,而苏维西塔单抗的获批填补了这一空白,为铂耐药卵巢癌患者提供了新的治疗选择。
苏维西塔单抗是一款重组人源化抗VEGF单克隆抗体,具有精准阻断VEGF通路的能力,已在临床前研究中展现出较同类药物(如贝伐珠单抗)更强的抑制血管生成与肿瘤活性的效果。与贝伐珠单抗不同,苏维西塔单抗的剂量更小,仅为1.5 mg/kg(每两周一次),远低于贝伐珠单抗的常规剂量(10 mg/kg每两周或15 mg/kg每三周)。这一特性使得苏维西塔单抗在治疗过程中具备更好的耐受性和便捷性。
差异化策略,抢占增量市场
作为国内首款用于治疗铂耐药卵巢癌的VEGF靶向药物,苏维西塔单抗在临床中的独特定位使其有望迅速占领市场份额。由先声再明与Pyxis Oncology联合开发,苏维西塔单抗的生产将在先声再明位于南京的抗体工厂完成。凭借该工厂每年600万支的生产能力及公司覆盖全国近3000家医院的营销网络,苏维西塔单抗的快速供应和推广不成问题。尤其是这款药物可能在上市初期就纳入医保,进一步降低患者的治疗负担,从而为广大的铂耐药卵巢癌患者群体带来实质性的帮助。
先声药业的创新之路
苏维西塔单抗的获批,标志着先声药业创新管线的持续进步。继盐酸达利雷生片获得批准后,苏维西塔单抗成为公司2025年第二款获批的创新药。凭借近年来在研发上的强大投入,先声药业已经累计上市创新药10款,其中近5年内获批8款,创新药收入占比也已突破74%。随着更多创新药陆续问世,先声药业的转型成果愈加显著,创新药业务的市场占有率也将进一步提升。
总的来说,苏维西塔单抗的上市不仅为铂耐药卵巢癌患者带来了新的希望,也进一步推动了中国肿瘤治疗领域的靶向药物发展。随着创新药管线的不断推进,先声药业有望在未来的医药市场中占据更加重要的位置。