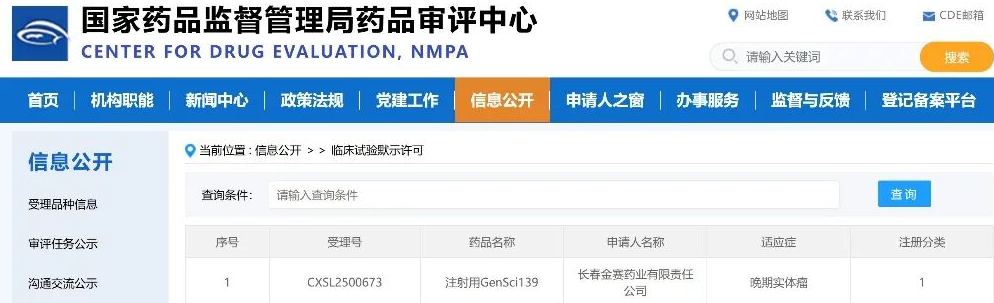
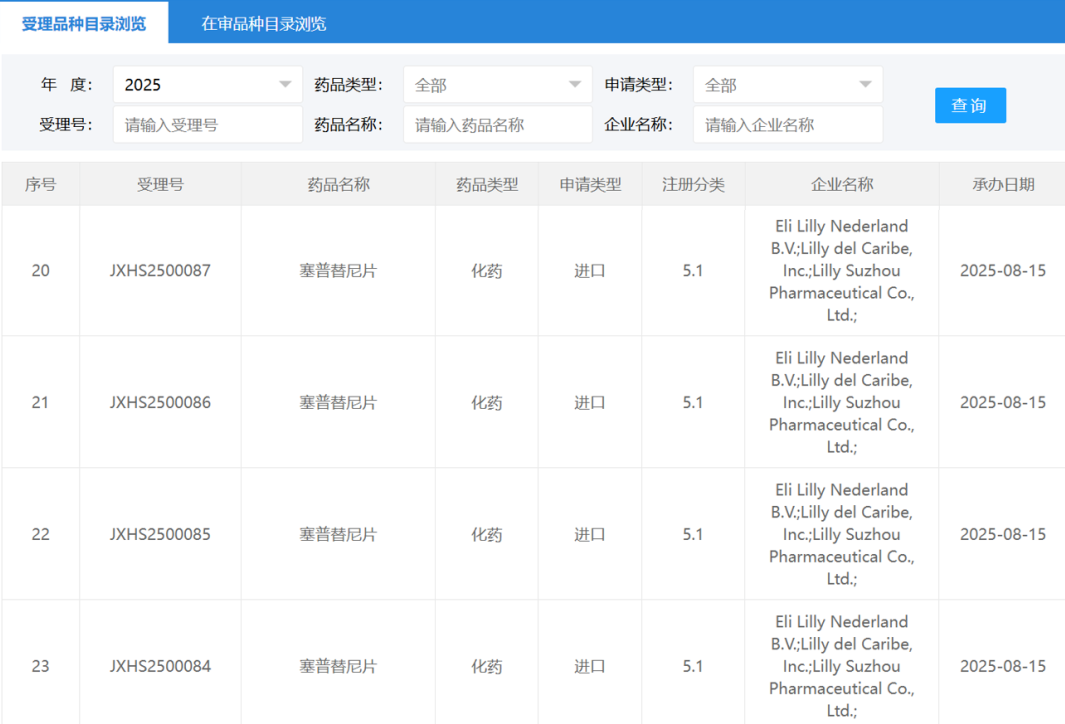
2025年8月15日,国家药品监督管理局(NMPA)药品审评中心(CDE)官网显示,礼来的塞普替尼新适应症上市申请已获受理。根据相关注册性临床研究进展推测,此次申报的适应症为治疗RET基因融合的局部晚期或转移性实体瘤儿童患者。若成功获批,将进一步扩展塞普替尼在儿童肿瘤治疗领域的应用。
塞普替尼:全球首个高选择性RET抑制剂
药物概况
塞普替尼是一种口服、高选择性的RET酪氨酸激酶抑制剂,通过靶向作用于突变或异常激活的RET通路,有效阻断肿瘤细胞的生长和扩散。
2020年5月,塞普替尼首次获得美国FDA批准上市,成为全球首个获批的高选择性RET抑制剂,随后逐步在全球多个市场获批。
国内适应症
2022年10月,塞普替尼在中国正式获批,用于以下三种RET基因改变相关适应症:
局部晚期或转移性非小细胞肺癌(RET融合阳性)成人患者;
12岁及以上儿童和成人患者:晚期或转移性RET突变型甲状腺髓样癌,需要系统性治疗;
12岁及以上儿童和成人患者:晚期或转移性RET融合阳性甲状腺癌,需要系统性治疗且放射性碘难治。
LIBRETTO-121研究:儿童RET基因改变实体瘤治疗的新进展
研究设计与目标
LIBRETTO-121是一项针对RET基因改变的晚期实体瘤或神经系统原发性肿瘤儿科患者的I/II期临床研究,旨在评估塞普替尼的疗效和安全性,为儿童肿瘤治疗扩展提供科学依据。
关键数据
在中位随访30个月的研究分析中,对36名可评估儿童患者的治疗效果表现如下:
整体疗效(ORR):总缓解率达36%;
长期效果:24个月无进展生存率(PFS)为86%;24个月缓解持续率(DOR)为100%。
细分疾病类别:
RET突变型甲状腺髓样癌患者(n=15):ORR为40%;
RET融合阳性甲状腺癌患者(n=15):ORR为33.3%。
研究进一步证实了塞普替尼在儿童肿瘤尤其是RET基因改变相关疾病中的疗效和安全性,为新适应症申报提供了坚实的数据支持。
RET基因融合:儿童实体瘤中的关键靶点
RET基因异常的特点
RET基因作为一种癌症驱动基因,其异常激活常见于多种类型的肿瘤,包括甲状腺癌、肺癌以及某些脑部肿瘤。在儿童中,RET基因融合或突变同样是实体瘤的重要病理特征之一。传统治疗手段存在疗效有限且副作用较大的问题,急需更精准、耐受性更好的新型靶向药物介入。
塞普替尼的优势
塞普替尼作为高选择性RET抑制剂,不仅能够精准靶向突变或融合RET基因相关的信号通路,且表现出良好的安全性与长期疗效,成为RET基因融合肿瘤治疗领域的潜在突破。
临床意义与未来展望
扩展适应症:填补治疗空白
塞普替尼新适应症申报以儿童RET基因融合实体瘤治疗为目标,这一群体尚缺少有效靶向治疗药物。若获批,将极大改善儿童患者的治疗选择,显著提高预后。
全球研发布局
塞普替尼已在全球范围内获得广泛认可,其疗效和安全性在多项研究中得到验证。从成人肿瘤患者到儿科患者的新适应症,塞普替尼正在通过不断扩展适应症来满足未被满足的临床需求,推动全球抗肿瘤研发的进步。
创新靶向治疗的未来潜力
作为全球首个高选择性RET抑制剂,塞普替尼不仅改变了RET基因融合相关肿瘤的治疗模式,也奠定了RET靶向治疗领域的临床应用基础。未来,随着适应症进一步扩展,塞普替尼有望造福更多患者,同时推动靶向治疗在精准医疗中的广泛应用。
总结
礼来的塞普替尼新适应症申报获受理,为治疗儿童RET基因融合相关实体瘤带来了新希望。凭借其良好的疗效和长期安全性,塞普替尼正在不断拓展治疗范围与价值。未来,随着更多适应症的获批与临床数据的积累,这一药物有望成为覆盖多年龄段和多种肿瘤类型的精准靶向治疗的代表性药物,为全球患者提供更多选择。