医药资讯
-
 FDA授予Zotiraciclib快速通道资格,用于治疗IDH突变型高级别脑胶质瘤 2025年11月15日,美国加利福尼亚州圣马特奥消息——科赛睿生物(Cothera Bioscience)宣布,其创新药物Zotiraciclib(ZTR/TG02)获美国食品和药物管理局(FDA)授予快速通道认定(Fast Track Designation),适用于治疗携带IDH1或IDH2突变的复发性高级别脑胶质瘤(IDHmut rHGG)患者。 这一认定标志着Zotiraciclib在脑胶质瘤精准治疗领域取得了重要进展,为临床患者带来了新的治疗希望。 强效多激酶抑制剂:突破血脑屏障的创新药物 Zotiraciclib是一种能够穿透血脑屏障的强效多靶点激酶抑制剂,其主要作用靶点为CDK9和PIM激酶。通过双重机制,Zotiraciclib能够降解短寿命的抗凋亡蛋白,破坏肿瘤细胞的生存信号通路,从而抑制肿瘤生长并促进细胞凋亡。 与传统疗法不同,Zotiraciclib可通过抑制PIM通路,干扰线粒体功能,削弱肿瘤细胞的能量代谢与应激反应能力。这种独特的机制使IDH突变型脑胶质瘤细胞更易受到药物作用,从而实现精准、高效的治疗。 单药疗法展现潜力,改善患者生活质量 研究显示,Zotiraciclib可通过合成致死机制(synthetic lethality)特异性作用于IDH突变型肿瘤细胞,在不依赖其他细胞毒性药物的情况下实现治疗效果。 这一特性使其有望成为IDHmut rHGG患者的单药治疗新方案,在提高疗效的同时减少联合化疗带来的副作用,从而显著改善患者的生活质量。 此外,临床前研究结果表明,Zotiraciclib在弥漫性内源性脑桥神经胶质瘤(DIPG)等其他中枢神经系统肿瘤中同样展现出良好的药理活性,为进一步拓展适应症奠定了基础。 推动脑肿瘤精准治疗新格局 Zotiraciclib的快速通道认定不仅代表FDA对其临床潜力的高度认可,也将加速药物的研发与上市进程。该药物的创新机制或将填补IDH突变型高级别脑胶质瘤在复发阶段缺乏有效治疗手段的空白。 随着Zotiraciclib的推进,科赛睿生物正致力于推动脑肿瘤精准治疗的发展,为患者提供更具靶向性、更安全、更高效的治疗选择。 结语 Zotiraciclib的获批进入快速通道,不仅是科赛睿生物的重要科研成果,也标志着脑胶质瘤治疗从传统细胞毒性药物向精准分子靶向药物的转变。未来,随着更多临床数据的积累,这款创新疗法有望成为IDH突变脑肿瘤患者的新希望,推动中枢神经系统恶性肿瘤治疗迈向新阶段。
FDA授予Zotiraciclib快速通道资格,用于治疗IDH突变型高级别脑胶质瘤 2025年11月15日,美国加利福尼亚州圣马特奥消息——科赛睿生物(Cothera Bioscience)宣布,其创新药物Zotiraciclib(ZTR/TG02)获美国食品和药物管理局(FDA)授予快速通道认定(Fast Track Designation),适用于治疗携带IDH1或IDH2突变的复发性高级别脑胶质瘤(IDHmut rHGG)患者。 这一认定标志着Zotiraciclib在脑胶质瘤精准治疗领域取得了重要进展,为临床患者带来了新的治疗希望。 强效多激酶抑制剂:突破血脑屏障的创新药物 Zotiraciclib是一种能够穿透血脑屏障的强效多靶点激酶抑制剂,其主要作用靶点为CDK9和PIM激酶。通过双重机制,Zotiraciclib能够降解短寿命的抗凋亡蛋白,破坏肿瘤细胞的生存信号通路,从而抑制肿瘤生长并促进细胞凋亡。 与传统疗法不同,Zotiraciclib可通过抑制PIM通路,干扰线粒体功能,削弱肿瘤细胞的能量代谢与应激反应能力。这种独特的机制使IDH突变型脑胶质瘤细胞更易受到药物作用,从而实现精准、高效的治疗。 单药疗法展现潜力,改善患者生活质量 研究显示,Zotiraciclib可通过合成致死机制(synthetic lethality)特异性作用于IDH突变型肿瘤细胞,在不依赖其他细胞毒性药物的情况下实现治疗效果。 这一特性使其有望成为IDHmut rHGG患者的单药治疗新方案,在提高疗效的同时减少联合化疗带来的副作用,从而显著改善患者的生活质量。 此外,临床前研究结果表明,Zotiraciclib在弥漫性内源性脑桥神经胶质瘤(DIPG)等其他中枢神经系统肿瘤中同样展现出良好的药理活性,为进一步拓展适应症奠定了基础。 推动脑肿瘤精准治疗新格局 Zotiraciclib的快速通道认定不仅代表FDA对其临床潜力的高度认可,也将加速药物的研发与上市进程。该药物的创新机制或将填补IDH突变型高级别脑胶质瘤在复发阶段缺乏有效治疗手段的空白。 随着Zotiraciclib的推进,科赛睿生物正致力于推动脑肿瘤精准治疗的发展,为患者提供更具靶向性、更安全、更高效的治疗选择。 结语 Zotiraciclib的获批进入快速通道,不仅是科赛睿生物的重要科研成果,也标志着脑胶质瘤治疗从传统细胞毒性药物向精准分子靶向药物的转变。未来,随着更多临床数据的积累,这款创新疗法有望成为IDH突变脑肿瘤患者的新希望,推动中枢神经系统恶性肿瘤治疗迈向新阶段。2025-11-22
-
 马塔西单抗注射液(友瑞宁)获批上市,为重型血友病患者带来新选择 近日,国家药品监督管理局(NMPA)正式批准Pfizer Inc.申报的马塔西单抗注射液(商品名:友瑞宁)上市,成为新的治疗方案,专为12岁及以上的重型A型血友病和重型B型血友病患者提供常规预防治疗。此药适用于体重≥35 kg的患者,旨在防止出血并降低出血发作频率,为这一类患者带来了新的治疗希望。 适应症:重型A型与B型血友病患者 马塔西单抗注射液的批准,主要针对重型A型血友病(先天性凝血因子VIII缺乏,FVIII<1%)和重型B型血友病(先天性凝血因子IX缺乏,FIX<1%)患者。这些患者通常面临频繁的出血问题,且难以通过传统治疗手段完全预防出血或控制发作频率。 值得注意的是,该药特别适用于没有凝血因子VIII或凝血因子IX抑制物的患者群体,填补了目前临床治疗中缺乏长期有效预防药物的空白。 新药上市:为患者提供更多选择 马塔西单抗注射液的上市,为重型血友病患者提供了新的治疗选择,进一步拓宽了血友病的治疗选项。该药物的常规预防治疗作用,不仅可以有效减少出血事件,还能帮助患者更好地管理日常生活,提升生活质量。 随着这一新疗法的上市,患者可以通过该药物得到长期预防,而不再依赖于频繁的急性治疗,显著改善了治疗的连续性和稳定性。 结语:为血友病患者带来新的希望 马塔西单抗注射液的批准,不仅为血友病患者带来了更多的治疗选择,也为整个医学领域在基因治疗与免疫治疗方面的应用提供了新的探索路径。随着未来临床数据的进一步积累,预计这一新疗法将在更多患者中推广,成为血友病治疗的重要组成部分。
马塔西单抗注射液(友瑞宁)获批上市,为重型血友病患者带来新选择 近日,国家药品监督管理局(NMPA)正式批准Pfizer Inc.申报的马塔西单抗注射液(商品名:友瑞宁)上市,成为新的治疗方案,专为12岁及以上的重型A型血友病和重型B型血友病患者提供常规预防治疗。此药适用于体重≥35 kg的患者,旨在防止出血并降低出血发作频率,为这一类患者带来了新的治疗希望。 适应症:重型A型与B型血友病患者 马塔西单抗注射液的批准,主要针对重型A型血友病(先天性凝血因子VIII缺乏,FVIII<1%)和重型B型血友病(先天性凝血因子IX缺乏,FIX<1%)患者。这些患者通常面临频繁的出血问题,且难以通过传统治疗手段完全预防出血或控制发作频率。 值得注意的是,该药特别适用于没有凝血因子VIII或凝血因子IX抑制物的患者群体,填补了目前临床治疗中缺乏长期有效预防药物的空白。 新药上市:为患者提供更多选择 马塔西单抗注射液的上市,为重型血友病患者提供了新的治疗选择,进一步拓宽了血友病的治疗选项。该药物的常规预防治疗作用,不仅可以有效减少出血事件,还能帮助患者更好地管理日常生活,提升生活质量。 随着这一新疗法的上市,患者可以通过该药物得到长期预防,而不再依赖于频繁的急性治疗,显著改善了治疗的连续性和稳定性。 结语:为血友病患者带来新的希望 马塔西单抗注射液的批准,不仅为血友病患者带来了更多的治疗选择,也为整个医学领域在基因治疗与免疫治疗方面的应用提供了新的探索路径。随着未来临床数据的进一步积累,预计这一新疗法将在更多患者中推广,成为血友病治疗的重要组成部分。2025-11-22
-
 中国药科大学团队打造“病毒样”肿瘤疫苗系统,为实体瘤免疫治疗带来新突破 肿瘤新抗原(Tumour Neoantigen)因其只存在于癌细胞中、不出现在正常组织内,被认为是理想的肿瘤免疫治疗靶点。近年来,基于新抗原的个体化疫苗研发成为癌症精准治疗的重要方向。目前,全球范围内已有超过一百项临床试验正在验证新抗原疫苗的安全性与有效性。 然而,这一方向依然面临三大挑战:其一,新抗原的免疫原性较低,仅有约 15%–30% 能够激活 T 细胞产生有效免疫反应;其二,实体瘤内部高度异质,导致靶点不稳定;其三,抑制性肿瘤免疫微环境(TIME)会削弱免疫细胞的效应功能,使疗效受限。正因如此,新抗原疫苗在实体瘤治疗中的整体响应率仍不理想。 从微生物免疫中获得灵感 与肿瘤新抗原相比,微生物抗原具有明确的分子结构和显著的免疫原性,能迅速激活记忆性 T 细胞清除感染细胞。受到这一特性的启发,中国药科大学杨勇教授与王文广副研究员团队,提出了一个创新构想:能否让肿瘤细胞“伪装”成高免疫原性的“病毒”,以此唤醒体内长期存在的病毒特异性免疫记忆,从而精准清除癌细胞? H-TVAC 系统:让肿瘤“伪装”成病毒 基于多年对溶瘤细菌与病毒免疫机制的研究积累,研究团队成功开发出一种特异性异源蛋白标记体系,构建了可表达乙型肝炎病毒表面抗原(HBsAg)的通用型肿瘤疫苗系统(HBsAg-tagged tumour vaccine system,简称 H-TVAC)。 该体系通过在肿瘤细胞表面表达 HBsAg,使其被免疫系统识别为“病毒感染细胞”,从而激活并重定向体内的 HBV 特异性记忆 T 细胞。 这些被唤醒的记忆 T 细胞能够突破 TIME 的抑制,直接识别并杀伤肿瘤细胞,同时诱导更广泛的表位扩展与长期免疫记忆,形成持续的抗肿瘤防御。 显著疗效:攻克多种“免疫冷肿瘤” 研究结果显示,H-TVAC 系统在多种动物模型中展现出强大的抗肿瘤效果,包括结直肠癌、乳腺癌和肝癌等传统意义上的“免疫冷肿瘤”。接种 H-TVAC 的实验组中,肿瘤增殖受到明显抑制,转移与复发风险显著下降。 相比目前基于新抗原筛选的个体化疫苗,H-TVAC 体系无需复杂的抗原预测流程,具有制备周期短、成本低、免疫反应强等优势,为通用型肿瘤疫苗的研发提供了可行路径。 机制创新:以记忆 T 细胞为突破口 研究团队发现,病毒或细菌特异性记忆 T 细胞在抑制性肿瘤微环境中仍能维持强大的效应活性,不易出现功能衰竭。H-TVAC 正是利用这一特性,通过“病毒样”肿瘤细胞主动吸引这些记忆 T 细胞,从而实现对实体瘤的精准清除。 这种创新机制突破了传统免疫治疗依赖新抗原激活初始 T 细胞的限制,标志着肿瘤免疫治疗从“诱导新应答”走向“唤醒既有免疫”的新阶段。 临床前景与团队介绍 该研究以 “HBsAg-tagged tumour vaccine system eliminates solid tumours through virus-specific memory T cells” 为题,于 2025 年 11 月 17 日 发表在 Nature Biomedical Engineering(《自然·生物医学工程》) 上。 论文由中国药科大学王文广副研究员、博士生褚亚、赵莉莉、吕淼共同担任第一作者;杨勇教授、王文广副研究员、赵维俊副研究员、柳铁中心医院左曙光副研究员及南京大学胡一桥教授为共同通讯作者,中国药科大学为第一通讯单位。 目前,研究团队正加速推动 H-TVAC 技术的临床转化,并诚邀对肿瘤疫苗与免疫治疗感兴趣的硕博研究生及产业合作伙伴共同探索肿瘤免疫治疗的新方向。
中国药科大学团队打造“病毒样”肿瘤疫苗系统,为实体瘤免疫治疗带来新突破 肿瘤新抗原(Tumour Neoantigen)因其只存在于癌细胞中、不出现在正常组织内,被认为是理想的肿瘤免疫治疗靶点。近年来,基于新抗原的个体化疫苗研发成为癌症精准治疗的重要方向。目前,全球范围内已有超过一百项临床试验正在验证新抗原疫苗的安全性与有效性。 然而,这一方向依然面临三大挑战:其一,新抗原的免疫原性较低,仅有约 15%–30% 能够激活 T 细胞产生有效免疫反应;其二,实体瘤内部高度异质,导致靶点不稳定;其三,抑制性肿瘤免疫微环境(TIME)会削弱免疫细胞的效应功能,使疗效受限。正因如此,新抗原疫苗在实体瘤治疗中的整体响应率仍不理想。 从微生物免疫中获得灵感 与肿瘤新抗原相比,微生物抗原具有明确的分子结构和显著的免疫原性,能迅速激活记忆性 T 细胞清除感染细胞。受到这一特性的启发,中国药科大学杨勇教授与王文广副研究员团队,提出了一个创新构想:能否让肿瘤细胞“伪装”成高免疫原性的“病毒”,以此唤醒体内长期存在的病毒特异性免疫记忆,从而精准清除癌细胞? H-TVAC 系统:让肿瘤“伪装”成病毒 基于多年对溶瘤细菌与病毒免疫机制的研究积累,研究团队成功开发出一种特异性异源蛋白标记体系,构建了可表达乙型肝炎病毒表面抗原(HBsAg)的通用型肿瘤疫苗系统(HBsAg-tagged tumour vaccine system,简称 H-TVAC)。 该体系通过在肿瘤细胞表面表达 HBsAg,使其被免疫系统识别为“病毒感染细胞”,从而激活并重定向体内的 HBV 特异性记忆 T 细胞。 这些被唤醒的记忆 T 细胞能够突破 TIME 的抑制,直接识别并杀伤肿瘤细胞,同时诱导更广泛的表位扩展与长期免疫记忆,形成持续的抗肿瘤防御。 显著疗效:攻克多种“免疫冷肿瘤” 研究结果显示,H-TVAC 系统在多种动物模型中展现出强大的抗肿瘤效果,包括结直肠癌、乳腺癌和肝癌等传统意义上的“免疫冷肿瘤”。接种 H-TVAC 的实验组中,肿瘤增殖受到明显抑制,转移与复发风险显著下降。 相比目前基于新抗原筛选的个体化疫苗,H-TVAC 体系无需复杂的抗原预测流程,具有制备周期短、成本低、免疫反应强等优势,为通用型肿瘤疫苗的研发提供了可行路径。 机制创新:以记忆 T 细胞为突破口 研究团队发现,病毒或细菌特异性记忆 T 细胞在抑制性肿瘤微环境中仍能维持强大的效应活性,不易出现功能衰竭。H-TVAC 正是利用这一特性,通过“病毒样”肿瘤细胞主动吸引这些记忆 T 细胞,从而实现对实体瘤的精准清除。 这种创新机制突破了传统免疫治疗依赖新抗原激活初始 T 细胞的限制,标志着肿瘤免疫治疗从“诱导新应答”走向“唤醒既有免疫”的新阶段。 临床前景与团队介绍 该研究以 “HBsAg-tagged tumour vaccine system eliminates solid tumours through virus-specific memory T cells” 为题,于 2025 年 11 月 17 日 发表在 Nature Biomedical Engineering(《自然·生物医学工程》) 上。 论文由中国药科大学王文广副研究员、博士生褚亚、赵莉莉、吕淼共同担任第一作者;杨勇教授、王文广副研究员、赵维俊副研究员、柳铁中心医院左曙光副研究员及南京大学胡一桥教授为共同通讯作者,中国药科大学为第一通讯单位。 目前,研究团队正加速推动 H-TVAC 技术的临床转化,并诚邀对肿瘤疫苗与免疫治疗感兴趣的硕博研究生及产业合作伙伴共同探索肿瘤免疫治疗的新方向。2025-11-19
-
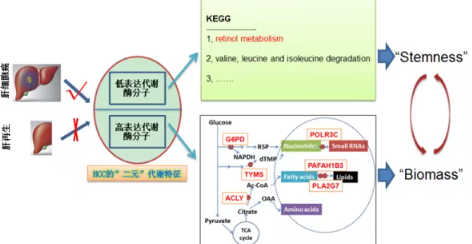 中科院团队揭示肝癌与肝再生的关键代谢差异,开创全新联合治疗策略 近日,中国科学院合肥物质科学研究院杨武林研究员带领的科研团队在肝细胞癌(Hepatocellular Carcinoma, HCC)研究中取得重要突破。团队揭示了肝癌与正常肝组织在代谢机制上的本质差异,并发现通过同时靶向特定代谢酶与补充维生素A衍生物,可显著提升肝癌抑制效果,为临床治疗带来新的可能。 肝癌与肝再生的代谢差异成为研究关键 肝脏具备强大的再生能力,但肝细胞癌的恶性生长与正常肝组织修复存在显著差异。传统的靶向药物虽然能延缓病情,却常因耐药性和副作用限制疗效。针对这一问题,科研团队系统比对了肝癌细胞与良性再生肝细胞的基因表达谱,找出了六种在代谢活动中异常活跃的关键酶。 这些酶促使癌细胞快速制造蛋白质、脂质等大分子物质,从而维持其高速度的分裂与扩张。其中,ATP柠檬酸裂解酶、葡萄糖-6-磷酸脱氢酶、胸苷酸合成酶三者被确定为代谢通路的上游“核心驱动点”,是抑制肝癌的理想靶标。 视黄酸代谢障碍揭示肿瘤干细胞的新弱点 进一步研究发现,肝癌细胞的视黄醇(维生素A)代谢路径受阻,导致视黄酸的生成显著下降。而视黄酸正是抑制肿瘤干细胞自我更新的重要分子。该机制的缺陷意味着肝癌细胞失去了一个天然的“刹车系统”,从而获得了持续生长的能力。 “代谢酶抑制剂+视黄酸”双靶联合疗法效果显著 基于上述机制,研究团队提出一种全新的联合疗法策略:在阻断癌细胞能量代谢的同时,恢复被削弱的视黄酸信号。实验采用特异性代谢酶抑制剂联合视黄酸干预,结果显示该疗法能在体外显著抑制肝癌细胞增殖,并在动物实验中展现出超过临床药物索拉非尼的抗肿瘤效果。 这一组合方案实现了从“阻止细胞生长”到“阻断癌细胞再生”的双重打击,为传统单靶点药物难以解决的耐药性问题提供了新思路。 打通代谢网络精准治疗新路径 该研究成功突破了以往针对单一代谢靶点的局限,通过系统性干预癌细胞的代谢网络,为多维度精准治疗提供了科学依据。研究成果不仅为肝癌治疗提供了新的药物组合模式,也为其他代谢异常相关癌症研究树立了新的研究范式。 相关成果已发表于国际权威期刊《International Journal of Biological Macromolecules》(《国际生物大分子杂志》)。
中科院团队揭示肝癌与肝再生的关键代谢差异,开创全新联合治疗策略 近日,中国科学院合肥物质科学研究院杨武林研究员带领的科研团队在肝细胞癌(Hepatocellular Carcinoma, HCC)研究中取得重要突破。团队揭示了肝癌与正常肝组织在代谢机制上的本质差异,并发现通过同时靶向特定代谢酶与补充维生素A衍生物,可显著提升肝癌抑制效果,为临床治疗带来新的可能。 肝癌与肝再生的代谢差异成为研究关键 肝脏具备强大的再生能力,但肝细胞癌的恶性生长与正常肝组织修复存在显著差异。传统的靶向药物虽然能延缓病情,却常因耐药性和副作用限制疗效。针对这一问题,科研团队系统比对了肝癌细胞与良性再生肝细胞的基因表达谱,找出了六种在代谢活动中异常活跃的关键酶。 这些酶促使癌细胞快速制造蛋白质、脂质等大分子物质,从而维持其高速度的分裂与扩张。其中,ATP柠檬酸裂解酶、葡萄糖-6-磷酸脱氢酶、胸苷酸合成酶三者被确定为代谢通路的上游“核心驱动点”,是抑制肝癌的理想靶标。 视黄酸代谢障碍揭示肿瘤干细胞的新弱点 进一步研究发现,肝癌细胞的视黄醇(维生素A)代谢路径受阻,导致视黄酸的生成显著下降。而视黄酸正是抑制肿瘤干细胞自我更新的重要分子。该机制的缺陷意味着肝癌细胞失去了一个天然的“刹车系统”,从而获得了持续生长的能力。 “代谢酶抑制剂+视黄酸”双靶联合疗法效果显著 基于上述机制,研究团队提出一种全新的联合疗法策略:在阻断癌细胞能量代谢的同时,恢复被削弱的视黄酸信号。实验采用特异性代谢酶抑制剂联合视黄酸干预,结果显示该疗法能在体外显著抑制肝癌细胞增殖,并在动物实验中展现出超过临床药物索拉非尼的抗肿瘤效果。 这一组合方案实现了从“阻止细胞生长”到“阻断癌细胞再生”的双重打击,为传统单靶点药物难以解决的耐药性问题提供了新思路。 打通代谢网络精准治疗新路径 该研究成功突破了以往针对单一代谢靶点的局限,通过系统性干预癌细胞的代谢网络,为多维度精准治疗提供了科学依据。研究成果不仅为肝癌治疗提供了新的药物组合模式,也为其他代谢异常相关癌症研究树立了新的研究范式。 相关成果已发表于国际权威期刊《International Journal of Biological Macromolecules》(《国际生物大分子杂志》)。2025-11-19
-
 Cell子刊最新研究:乳酸“逆袭”为信号分子,激活骨骼肌自噬促进运动适应 近年来,越来越多的研究表明,细胞自噬在运动过程中会被激活,并在调节机体代谢健康中发挥核心作用。然而,骨骼肌自噬在运动状态下的分子调控机制仍未被完全揭示。 2025年11月11日,江南大学食品学院王莉教授、李言研究员,以及中科院上海营养与健康研究所应浩研究员、安利纽崔莱营养健康研究中心团队在Cell Chemical Biology发表了最新研究成果—— 题为《Lactylation of mTOR enhances autophagy in skeletal muscle during exercise》的论文。 该研究揭示了:运动过程中产生的乳酸能够通过修饰mTOR蛋白的特定位点,从而增强骨骼肌细胞自噬功能,这一机制为理解运动带来的健康益处提供了全新视角。 乳酸不只是“代谢废物”,更是自噬信号触发器 研究团队发现,在运动状态下,体内乳酸水平迅速上升,而这种代谢产物并非只是能量代谢的“副产物”,它在肌肉细胞中扮演了细胞自噬的正向调控角色。 当研究人员利用基因编辑手段让小鼠缺失肌细胞内的乳酸脱氢酶A(LDHA)后,乳酸水平显著下降,这些小鼠的骨骼肌出现了明显异常,表现为细胞自噬受损、代谢紊乱。 这一结果提示——乳酸并非无用的代谢残余,而是维持骨骼肌健康的关键信号分子。 揭示新机制:乳酸化修饰调控mTORC1活性 在分子机制层面,研究团队发现乳酸通过促进mTOR蛋白第921位赖氨酸(K921)的乳酸化修饰,从而抑制mTORC1复合物的活性,最终增强细胞自噬。 相反,当mTOR的K921位点发生突变,无法完成乳酸化修饰时,mTORC1信号持续处于激活状态,导致自噬功能下降,肌肉细胞代谢受阻。 这意味着,乳酸化(lactylation)作为一种新型蛋白质翻译后修饰,在运动诱导的骨骼肌适应中扮演了“分子开关”的角色。 重新定义乳酸:代谢与信号的双重身份 这项研究颠覆了传统认知,将乳酸从单纯的代谢副产物重新定义为调控运动适应的信号分子。 通过mTOR蛋白K921位点的乳酸化修饰,乳酸不仅参与能量代谢,更直接调控自噬过程,维持肌肉稳态。 研究结果为理解“运动如何将代谢变化转化为细胞适应反应”提供了新的理论框架,也为肌肉衰退、代谢紊乱及相关疾病的干预策略开辟了新的方向。 未来展望:从运动机制到疾病治疗的新启示 王莉教授团队的这一发现,为未来运动生理学与代谢疾病研究带来了重要启示: 通过调控乳酸信号通路或乳酸化修饰过程,或许有望开发新的代谢疾病治疗药物,改善肌肉功能障碍。 乳酸,这个曾被视为“疲劳标志”的分子,正逐渐展现出它在健康调控与代谢平衡中的真正力量。
Cell子刊最新研究:乳酸“逆袭”为信号分子,激活骨骼肌自噬促进运动适应 近年来,越来越多的研究表明,细胞自噬在运动过程中会被激活,并在调节机体代谢健康中发挥核心作用。然而,骨骼肌自噬在运动状态下的分子调控机制仍未被完全揭示。 2025年11月11日,江南大学食品学院王莉教授、李言研究员,以及中科院上海营养与健康研究所应浩研究员、安利纽崔莱营养健康研究中心团队在Cell Chemical Biology发表了最新研究成果—— 题为《Lactylation of mTOR enhances autophagy in skeletal muscle during exercise》的论文。 该研究揭示了:运动过程中产生的乳酸能够通过修饰mTOR蛋白的特定位点,从而增强骨骼肌细胞自噬功能,这一机制为理解运动带来的健康益处提供了全新视角。 乳酸不只是“代谢废物”,更是自噬信号触发器 研究团队发现,在运动状态下,体内乳酸水平迅速上升,而这种代谢产物并非只是能量代谢的“副产物”,它在肌肉细胞中扮演了细胞自噬的正向调控角色。 当研究人员利用基因编辑手段让小鼠缺失肌细胞内的乳酸脱氢酶A(LDHA)后,乳酸水平显著下降,这些小鼠的骨骼肌出现了明显异常,表现为细胞自噬受损、代谢紊乱。 这一结果提示——乳酸并非无用的代谢残余,而是维持骨骼肌健康的关键信号分子。 揭示新机制:乳酸化修饰调控mTORC1活性 在分子机制层面,研究团队发现乳酸通过促进mTOR蛋白第921位赖氨酸(K921)的乳酸化修饰,从而抑制mTORC1复合物的活性,最终增强细胞自噬。 相反,当mTOR的K921位点发生突变,无法完成乳酸化修饰时,mTORC1信号持续处于激活状态,导致自噬功能下降,肌肉细胞代谢受阻。 这意味着,乳酸化(lactylation)作为一种新型蛋白质翻译后修饰,在运动诱导的骨骼肌适应中扮演了“分子开关”的角色。 重新定义乳酸:代谢与信号的双重身份 这项研究颠覆了传统认知,将乳酸从单纯的代谢副产物重新定义为调控运动适应的信号分子。 通过mTOR蛋白K921位点的乳酸化修饰,乳酸不仅参与能量代谢,更直接调控自噬过程,维持肌肉稳态。 研究结果为理解“运动如何将代谢变化转化为细胞适应反应”提供了新的理论框架,也为肌肉衰退、代谢紊乱及相关疾病的干预策略开辟了新的方向。 未来展望:从运动机制到疾病治疗的新启示 王莉教授团队的这一发现,为未来运动生理学与代谢疾病研究带来了重要启示: 通过调控乳酸信号通路或乳酸化修饰过程,或许有望开发新的代谢疾病治疗药物,改善肌肉功能障碍。 乳酸,这个曾被视为“疲劳标志”的分子,正逐渐展现出它在健康调控与代谢平衡中的真正力量。2025-11-18
-
 国产创新药维培那肽正式获批上市:为2型糖尿病治疗带来新突破 11月14日,国家药品监督管理局(NMPA)发布公告,派格生物自主研发的国家1类创新药——维培那肽注射液(商品名:派达康®)正式获批上市,用于治疗2型糖尿病(T2DM)。消息公布后,派格生物股价尾盘大涨逾12%,引发业内广泛关注。 新一代GLP-1受体激动剂,为糖尿病治疗注入“新动力” 近年来,随着中国糖尿病防治体系的持续完善,患者对治疗方案提出了更高要求——既要降糖有效,又要安全便捷。GLP-1受体激动剂(GLP-1RA) 作为当前糖尿病治疗领域的热门药物,以其显著的降糖作用、低低血糖风险及心肾代谢多重获益,已被各大国际国内指南列为一线推荐治疗药物。 不过,传统GLP-1RA仍存在一些临床痛点,如胃肠道不良反应频发、剂量滴定复杂 等问题,影响了患者的依从性与长期疗效。 分子结构创新,带来更高效与更安全的药理特性 公开资料显示,维培那肽的核心优势来自其创新的分子设计与定点PEG化技术。通过在特定位点引入PEG基团,药物可有效抵抗DPP-4酶降解,同时显著降低肾脏清除率。 这种结构改造赋予维培那肽一系列优势: 与GLP-1受体高效结合,确保药物快速起效; 延长药物半衰期,实现更持久的血糖控制; 减少免疫反应与胃肠道不适,提高耐受性; 降低体内蓄积风险,保障长期用药安全。 这些创新使维培那肽能够在疗效、安全性和使用便捷性之间实现理想平衡。 临床验证:优效降糖与良好耐受性的双重表现 作为新一代长效GLP-1RA周制剂,维培那肽在Ⅰ至Ⅲ期临床研究中展现出优异的综合表现。研究数据显示,该药不仅在降糖效果上达到甚至超过部分同类产品,还表现出较低的胃肠道不良反应发生率,患者耐受性良好。 凭借这种“高效+安全+便捷”的优势,维培那肽有望成为中国2型糖尿病患者新的治疗选择,为提高依从性、延缓并发症、优化长期血糖管理提供新的可能。 总结:国产创新药的里程碑式进展 维培那肽的获批标志着国产GLP-1创新药物进入全新阶段。它不仅是派格生物在糖尿病领域自主研发的重大成果,也意味着中国药企在高端生物制剂领域的持续突破。 未来,随着临床应用的逐步推广,维培那肽有望助力更多T2DM患者实现血糖稳定控制,并推动我国糖尿病治疗向更精准、更便捷、更人性化的方向发展。
国产创新药维培那肽正式获批上市:为2型糖尿病治疗带来新突破 11月14日,国家药品监督管理局(NMPA)发布公告,派格生物自主研发的国家1类创新药——维培那肽注射液(商品名:派达康®)正式获批上市,用于治疗2型糖尿病(T2DM)。消息公布后,派格生物股价尾盘大涨逾12%,引发业内广泛关注。 新一代GLP-1受体激动剂,为糖尿病治疗注入“新动力” 近年来,随着中国糖尿病防治体系的持续完善,患者对治疗方案提出了更高要求——既要降糖有效,又要安全便捷。GLP-1受体激动剂(GLP-1RA) 作为当前糖尿病治疗领域的热门药物,以其显著的降糖作用、低低血糖风险及心肾代谢多重获益,已被各大国际国内指南列为一线推荐治疗药物。 不过,传统GLP-1RA仍存在一些临床痛点,如胃肠道不良反应频发、剂量滴定复杂 等问题,影响了患者的依从性与长期疗效。 分子结构创新,带来更高效与更安全的药理特性 公开资料显示,维培那肽的核心优势来自其创新的分子设计与定点PEG化技术。通过在特定位点引入PEG基团,药物可有效抵抗DPP-4酶降解,同时显著降低肾脏清除率。 这种结构改造赋予维培那肽一系列优势: 与GLP-1受体高效结合,确保药物快速起效; 延长药物半衰期,实现更持久的血糖控制; 减少免疫反应与胃肠道不适,提高耐受性; 降低体内蓄积风险,保障长期用药安全。 这些创新使维培那肽能够在疗效、安全性和使用便捷性之间实现理想平衡。 临床验证:优效降糖与良好耐受性的双重表现 作为新一代长效GLP-1RA周制剂,维培那肽在Ⅰ至Ⅲ期临床研究中展现出优异的综合表现。研究数据显示,该药不仅在降糖效果上达到甚至超过部分同类产品,还表现出较低的胃肠道不良反应发生率,患者耐受性良好。 凭借这种“高效+安全+便捷”的优势,维培那肽有望成为中国2型糖尿病患者新的治疗选择,为提高依从性、延缓并发症、优化长期血糖管理提供新的可能。 总结:国产创新药的里程碑式进展 维培那肽的获批标志着国产GLP-1创新药物进入全新阶段。它不仅是派格生物在糖尿病领域自主研发的重大成果,也意味着中国药企在高端生物制剂领域的持续突破。 未来,随着临床应用的逐步推广,维培那肽有望助力更多T2DM患者实现血糖稳定控制,并推动我国糖尿病治疗向更精准、更便捷、更人性化的方向发展。2025-11-18
-
 天津医科大学团队在《Science》发文:FPR1 成为多发性硬化症潜在治疗新靶点 多发性硬化症(Multiple Sclerosis,简称 MS)是一种影响中枢神经系统的慢性脱髓鞘疾病,其发病机制复杂,常伴随炎症反复及神经退行性改变。虽然现有的疾病修正治疗(DMTs)能减少复发并延缓病情发展,但对持续性神经退化和局部脑部炎症的控制依然有限。因此,科研人员一直在努力寻找能够阻止疾病进展的新靶点。 近日,天津医科大学总医院施福东教授团队在国际权威期刊《Science》发表最新研究成果,论文题为 “Targeting formyl peptide receptor 1 reduces brain inflammation and neurodegeneration”。研究揭示了甲酰肽受体1(FPR1)在多发性硬化症进展中的关键作用,并发现了一种能够有效阻断其信号通路的小分子拮抗剂 T0080,为多发性硬化症的治疗带来了全新方向。 FPR1:连接炎症与神经退化的“桥梁” 在多发性硬化症中,脑部病灶往往伴随着小胶质细胞的活化和增生。这些细胞与外周来源的巨噬细胞协同,引发持续的先天免疫反应,从而推动神经退行性变。研究发现,受损的神经细胞会释放危险信号分子(DAMPs),其中线粒体来源的甲酰肽(mtFP)尤为关键。 这些内源性甲酰肽能与主要存在于小胶质细胞和巨噬细胞表面的 FPR1 结合,激活其下游信号通路,导致炎症反应持续放大。研究者指出,FPR1 的过度激活不仅诱导活性氧(ROS)和炎性细胞因子(如 TNF-α)的释放,还破坏了神经轴突结构,加速了髓鞘损伤与神经功能丧失。 临床样本与动物模型揭示:FPR1 高表达与病情进展密切相关 团队通过分析多发性硬化症患者脑组织样本发现,在脱髓鞘活动性病变区,FPR1 在小胶质细胞及中枢浸润的巨噬细胞中均显著上调。同时,血液中内源性 N-甲酰化肽水平与患者病情进展呈动态正相关,提示 FPR1 信号可能参与了疾病的持续恶化过程。 在实验性自身免疫性脑脊髓炎(EAE)小鼠模型中,FPR1 激活可通过 PKC 依赖的信号通路促使小胶质细胞持续释放炎性分子与活性氧,加重神经损伤。与此同时,这些细胞分泌趋化因子 CCL5,吸引髓鞘反应性 CD4+ T 细胞进入中枢神经系统,并促进其释放干扰素 γ(IFN-γ),形成恶性正反馈回路,使炎症持续活跃。 T0080:能够穿越血脑屏障的 FPR1 抑制剂 为寻找能够阻断该通路的有效药物,研究团队利用计算机辅助药物筛选,从数百万种化合物中优化出一款可穿越血脑屏障的 FPR1 小分子拮抗剂——T0080。 在三种不同的多发性硬化症动物模型中,T0080 均显示出显著疗效。实验结果表明,T0080 不仅能够抑制外周和中枢神经系统的自身免疫反应,还能有效阻止小胶质细胞介导的轴突退变,从而延缓疾病的整体进程。 研究意义:为多发性硬化症治疗开辟新路径 该研究首次系统揭示了 FPR1 信号通路在维持慢性神经炎症和推动神经退行性变化中的关键作用。通过药物性阻断 FPR1,可以同时减少脑部炎症反应与神经元损伤,为未来开发多发性硬化症的新型治疗策略提供了坚实的理论基础。 天津医科大学施福东教授表示,这一发现不仅加深了人们对多发性硬化症病理机制的理解,也为临床开发 FPR1 靶向药物提供了重要依据。未来,T0080 及类似化合物有望成为减缓多发性硬化症进展、保护神经功能的新型治疗武器。 总结 该研究通过从机制到药物的全链条探索,揭示了 FPR1 在神经炎症持续化与退行性病变中的核心作用,并成功验证了 FPR1 抑制剂 T0080 的疗效。这一成果为多发性硬化症及其他神经炎症性疾病的精准治疗带来了新的希望。
天津医科大学团队在《Science》发文:FPR1 成为多发性硬化症潜在治疗新靶点 多发性硬化症(Multiple Sclerosis,简称 MS)是一种影响中枢神经系统的慢性脱髓鞘疾病,其发病机制复杂,常伴随炎症反复及神经退行性改变。虽然现有的疾病修正治疗(DMTs)能减少复发并延缓病情发展,但对持续性神经退化和局部脑部炎症的控制依然有限。因此,科研人员一直在努力寻找能够阻止疾病进展的新靶点。 近日,天津医科大学总医院施福东教授团队在国际权威期刊《Science》发表最新研究成果,论文题为 “Targeting formyl peptide receptor 1 reduces brain inflammation and neurodegeneration”。研究揭示了甲酰肽受体1(FPR1)在多发性硬化症进展中的关键作用,并发现了一种能够有效阻断其信号通路的小分子拮抗剂 T0080,为多发性硬化症的治疗带来了全新方向。 FPR1:连接炎症与神经退化的“桥梁” 在多发性硬化症中,脑部病灶往往伴随着小胶质细胞的活化和增生。这些细胞与外周来源的巨噬细胞协同,引发持续的先天免疫反应,从而推动神经退行性变。研究发现,受损的神经细胞会释放危险信号分子(DAMPs),其中线粒体来源的甲酰肽(mtFP)尤为关键。 这些内源性甲酰肽能与主要存在于小胶质细胞和巨噬细胞表面的 FPR1 结合,激活其下游信号通路,导致炎症反应持续放大。研究者指出,FPR1 的过度激活不仅诱导活性氧(ROS)和炎性细胞因子(如 TNF-α)的释放,还破坏了神经轴突结构,加速了髓鞘损伤与神经功能丧失。 临床样本与动物模型揭示:FPR1 高表达与病情进展密切相关 团队通过分析多发性硬化症患者脑组织样本发现,在脱髓鞘活动性病变区,FPR1 在小胶质细胞及中枢浸润的巨噬细胞中均显著上调。同时,血液中内源性 N-甲酰化肽水平与患者病情进展呈动态正相关,提示 FPR1 信号可能参与了疾病的持续恶化过程。 在实验性自身免疫性脑脊髓炎(EAE)小鼠模型中,FPR1 激活可通过 PKC 依赖的信号通路促使小胶质细胞持续释放炎性分子与活性氧,加重神经损伤。与此同时,这些细胞分泌趋化因子 CCL5,吸引髓鞘反应性 CD4+ T 细胞进入中枢神经系统,并促进其释放干扰素 γ(IFN-γ),形成恶性正反馈回路,使炎症持续活跃。 T0080:能够穿越血脑屏障的 FPR1 抑制剂 为寻找能够阻断该通路的有效药物,研究团队利用计算机辅助药物筛选,从数百万种化合物中优化出一款可穿越血脑屏障的 FPR1 小分子拮抗剂——T0080。 在三种不同的多发性硬化症动物模型中,T0080 均显示出显著疗效。实验结果表明,T0080 不仅能够抑制外周和中枢神经系统的自身免疫反应,还能有效阻止小胶质细胞介导的轴突退变,从而延缓疾病的整体进程。 研究意义:为多发性硬化症治疗开辟新路径 该研究首次系统揭示了 FPR1 信号通路在维持慢性神经炎症和推动神经退行性变化中的关键作用。通过药物性阻断 FPR1,可以同时减少脑部炎症反应与神经元损伤,为未来开发多发性硬化症的新型治疗策略提供了坚实的理论基础。 天津医科大学施福东教授表示,这一发现不仅加深了人们对多发性硬化症病理机制的理解,也为临床开发 FPR1 靶向药物提供了重要依据。未来,T0080 及类似化合物有望成为减缓多发性硬化症进展、保护神经功能的新型治疗武器。 总结 该研究通过从机制到药物的全链条探索,揭示了 FPR1 在神经炎症持续化与退行性病变中的核心作用,并成功验证了 FPR1 抑制剂 T0080 的疗效。这一成果为多发性硬化症及其他神经炎症性疾病的精准治疗带来了新的希望。2025-11-17
-
 间断禁食与线粒体自噬的关系:新发现揭示乙酰辅酶A的关键作用 间断禁食作为一种有效的减肥和健康促进方法,近年来受到越来越多人的青睐。研究表明,间断禁食不仅能帮助调节血糖、血脂,还能改善多种器官的功能,特别是对代谢和抗衰老具有积极影响。尽管如此,禁食如何具体影响细胞内的自噬过程,尤其是线粒体自噬,仍是一个未解的谜团。近日,复旦大学上海医学院雷群英团队在《自然》杂志上发表的一项研究,首次揭示了乙酰辅酶A在这一过程中扮演的“代谢信使”角色,为这一谜团提供了新线索。 线粒体自噬与乙酰辅酶A的关系 在禁食状态下,细胞内的线粒体质量会下降,而这一现象并非因为线粒体生成的减少,而是由于细胞启动了线粒体自噬机制。传统观念认为,细胞通过AMPK和mTOR等经典的“营养感知”通路来响应饥饿信号,但这次的研究发现,AMPK和mTOR并没有显著变化。这暗示着,存在一条新的、尚未被认知的信号通路在起作用。 通过质谱分析,研究团队发现,乙酰辅酶A在细胞内的水平变化与线粒体自噬的发生密切相关。乙酰辅酶A是细胞代谢的核心物质,它将糖、脂肪和蛋白质的代谢连接在一起。研究发现,在饥饿状态下,细胞质中的乙酰辅酶A水平显著下降,而这种变化正是启动线粒体自噬的关键信号。 NLRX1蛋白感知乙酰辅酶A并启动线粒体自噬 那么,细胞如何“读取”乙酰辅酶A水平的变化呢?研究者通过大规模的基因筛选,最终确定了NLRX1蛋白作为乙酰辅酶A信号的受体。NLRX1能够直接感知乙酰辅酶A的浓度变化,并在其下降时启动线粒体自噬过程。 在缺乏NLRX1功能的细胞中,不论是通过禁食还是通过药物抑制乙酰辅酶A生成,线粒体自噬均无法顺利启动。而在NLRX1基因敲除的小鼠中,药物或禁食诱导的线粒体自噬也被显著抑制。这表明,NLRX1蛋白在这一过程中起到了不可或缺的作用。 乙酰辅酶A与NLRX1结合的机制 通过进一步实验,研究人员发现NLRX1的LRR结构域形成了一个“口袋”,乙酰辅酶A能够与该结构域特异性结合。当饥饿导致细胞内乙酰辅酶A水平下降时,乙酰辅酶A从NLRX1上脱落,这一变化促使NLRX1发生寡聚化,并启动线粒体自噬过程。这一机制揭示了乙酰辅酶A在禁食引发的线粒体清理中的重要作用。 癌症治疗的新启示 除了阐明禁食对健康的益处,这一发现也为癌症治疗提供了新的视角。例如,研究发现癌细胞在接触KRAS抑制剂时,能主动降低乙酰辅酶A的水平,进而激活NLRX1介导的线粒体自噬。这一“自救机制”帮助癌细胞通过清理受损线粒体、减少活性氧的生成,降低氧化应激,从而增强其存活能力。这一发现可能为KRAS突变肿瘤的治疗提供了新的治疗策略。 总结 这项研究深入探讨了乙酰辅酶A在禁食引发的线粒体自噬过程中的作用,首次揭示了NLRX1蛋白如何感知乙酰辅酶A的变化并调控这一重要的自噬机制。这一发现不仅加深了我们对禁食如何影响细胞健康的理解,还为癌症治疗提供了新的思路,尤其是针对KRAS突变型肿瘤,开启了治疗的新可能。
间断禁食与线粒体自噬的关系:新发现揭示乙酰辅酶A的关键作用 间断禁食作为一种有效的减肥和健康促进方法,近年来受到越来越多人的青睐。研究表明,间断禁食不仅能帮助调节血糖、血脂,还能改善多种器官的功能,特别是对代谢和抗衰老具有积极影响。尽管如此,禁食如何具体影响细胞内的自噬过程,尤其是线粒体自噬,仍是一个未解的谜团。近日,复旦大学上海医学院雷群英团队在《自然》杂志上发表的一项研究,首次揭示了乙酰辅酶A在这一过程中扮演的“代谢信使”角色,为这一谜团提供了新线索。 线粒体自噬与乙酰辅酶A的关系 在禁食状态下,细胞内的线粒体质量会下降,而这一现象并非因为线粒体生成的减少,而是由于细胞启动了线粒体自噬机制。传统观念认为,细胞通过AMPK和mTOR等经典的“营养感知”通路来响应饥饿信号,但这次的研究发现,AMPK和mTOR并没有显著变化。这暗示着,存在一条新的、尚未被认知的信号通路在起作用。 通过质谱分析,研究团队发现,乙酰辅酶A在细胞内的水平变化与线粒体自噬的发生密切相关。乙酰辅酶A是细胞代谢的核心物质,它将糖、脂肪和蛋白质的代谢连接在一起。研究发现,在饥饿状态下,细胞质中的乙酰辅酶A水平显著下降,而这种变化正是启动线粒体自噬的关键信号。 NLRX1蛋白感知乙酰辅酶A并启动线粒体自噬 那么,细胞如何“读取”乙酰辅酶A水平的变化呢?研究者通过大规模的基因筛选,最终确定了NLRX1蛋白作为乙酰辅酶A信号的受体。NLRX1能够直接感知乙酰辅酶A的浓度变化,并在其下降时启动线粒体自噬过程。 在缺乏NLRX1功能的细胞中,不论是通过禁食还是通过药物抑制乙酰辅酶A生成,线粒体自噬均无法顺利启动。而在NLRX1基因敲除的小鼠中,药物或禁食诱导的线粒体自噬也被显著抑制。这表明,NLRX1蛋白在这一过程中起到了不可或缺的作用。 乙酰辅酶A与NLRX1结合的机制 通过进一步实验,研究人员发现NLRX1的LRR结构域形成了一个“口袋”,乙酰辅酶A能够与该结构域特异性结合。当饥饿导致细胞内乙酰辅酶A水平下降时,乙酰辅酶A从NLRX1上脱落,这一变化促使NLRX1发生寡聚化,并启动线粒体自噬过程。这一机制揭示了乙酰辅酶A在禁食引发的线粒体清理中的重要作用。 癌症治疗的新启示 除了阐明禁食对健康的益处,这一发现也为癌症治疗提供了新的视角。例如,研究发现癌细胞在接触KRAS抑制剂时,能主动降低乙酰辅酶A的水平,进而激活NLRX1介导的线粒体自噬。这一“自救机制”帮助癌细胞通过清理受损线粒体、减少活性氧的生成,降低氧化应激,从而增强其存活能力。这一发现可能为KRAS突变肿瘤的治疗提供了新的治疗策略。 总结 这项研究深入探讨了乙酰辅酶A在禁食引发的线粒体自噬过程中的作用,首次揭示了NLRX1蛋白如何感知乙酰辅酶A的变化并调控这一重要的自噬机制。这一发现不仅加深了我们对禁食如何影响细胞健康的理解,还为癌症治疗提供了新的思路,尤其是针对KRAS突变型肿瘤,开启了治疗的新可能。2025-11-17
-
 科学家揭示AML耐药新机制:靶向OPA1或成突破口 急性髓系白血病(AML)是成年人中最常见、但也最致命的白血病类型之一。尽管以维奈克拉(Venetoclax)为代表的BH3模拟物,通过抑制BCL-2蛋白促进细胞凋亡,已成为标准治疗方案,但耐药性几乎不可避免。近期,美国新泽西州立大学Christina Glytsou团队在《Science Advances》上发表的重要研究,为这一难题带来了新的解决思路——靶向线粒体重塑蛋白OPA1。 线粒体“重塑”让癌细胞死里逃生 研究团队发现,在维奈克拉耐药的AML细胞中,OPA1蛋白表达明显升高。这一蛋白负责调控线粒体内膜的折叠结构——即“线粒体嵴”。当OPA1过度表达时,嵴结构变得更加紧密,使得细胞色素c等关键凋亡因子被“困”在线粒体内部,阻断了细胞死亡信号的传递。 高分辨电子显微镜下的图像清晰显示:耐药细胞的线粒体嵴极度收缩、密集,仿佛为癌细胞筑起了“防凋亡堡垒”。在来自复发或难治性AML患者的样本中,也普遍观察到了类似的结构变化。 敲除或抑制OPA1:让耐药细胞“重新死亡” 为了验证OPA1的作用,研究者利用CRISPR-Cas9技术敲除了AML细胞中的OPA1基因。结果显示,缺失OPA1后,细胞对维奈克拉的敏感性显著提高,即使是已经产生耐药的细胞,也重新对药物产生反应。在小鼠实验中,OPA1缺失与维奈克拉联合治疗显著延长了白血病模型小鼠的生存期。 进一步地,研究团队开发并验证了两种小分子OPA1抑制剂——MYLS22和其改良版本Opitor-0。这两种药物可显著改变线粒体嵴的形态,使结构变得宽松,促进细胞色素c释放,重新激活凋亡通路。在多种AML细胞系及患者来源的异种移植模型(PDX)中,联合治疗均显示出强大的抗肿瘤协同效应,且对正常造血细胞影响较小,安全性较为理想。 双重打击:代谢脆弱性与铁死亡敏感性 研究不仅揭示了OPA1与凋亡逃逸的关系,还发现其抑制后,癌细胞代谢发生了明显变化。由于线粒体呼吸功能受损,AML细胞被迫转向依赖谷氨酰胺代谢以维持能量与抗氧化平衡。 在缺乏谷氨酰胺或使用谷氨酰胺酶抑制剂CB-839的情况下,这些细胞的生长显著受限。这一发现提示,OPA1抑制与代谢干预联合可能进一步增强治疗效果。 此外,OPA1抑制还会激活ATF4介导的整合应激反应,并上调多种与铁死亡(ferroptosis)相关的基因,如CHAC1。实验显示,使用铁死亡诱导剂Erastin时,MYLS22预处理可显著放大药效,使细胞出现更强的脂质过氧化反应,提示OPA1抑制+铁死亡诱导可能是未来值得探索的组合方案。 结语:靶向线粒体结构,或为AML治疗带来新曙光 本研究系统揭示了OPA1介导的线粒体重塑在AML耐药中的核心作用。从机制阐释到动物实验验证,结果一致表明:靶向OPA1不仅能恢复维奈克拉的疗效,还能暴露AML细胞的代谢与生存弱点。 作为潜在的联合治疗靶点,MYLS22与Opitor-0展现出良好的应用前景,尤其对于携带TP53突变等高危患者,或有望成为未来精准治疗的重要选择。 未来的研究或将进一步探索OPA1抑制与代谢调控、铁死亡诱导等多维联合策略,为攻克AML耐药提供新的思路与希望。
科学家揭示AML耐药新机制:靶向OPA1或成突破口 急性髓系白血病(AML)是成年人中最常见、但也最致命的白血病类型之一。尽管以维奈克拉(Venetoclax)为代表的BH3模拟物,通过抑制BCL-2蛋白促进细胞凋亡,已成为标准治疗方案,但耐药性几乎不可避免。近期,美国新泽西州立大学Christina Glytsou团队在《Science Advances》上发表的重要研究,为这一难题带来了新的解决思路——靶向线粒体重塑蛋白OPA1。 线粒体“重塑”让癌细胞死里逃生 研究团队发现,在维奈克拉耐药的AML细胞中,OPA1蛋白表达明显升高。这一蛋白负责调控线粒体内膜的折叠结构——即“线粒体嵴”。当OPA1过度表达时,嵴结构变得更加紧密,使得细胞色素c等关键凋亡因子被“困”在线粒体内部,阻断了细胞死亡信号的传递。 高分辨电子显微镜下的图像清晰显示:耐药细胞的线粒体嵴极度收缩、密集,仿佛为癌细胞筑起了“防凋亡堡垒”。在来自复发或难治性AML患者的样本中,也普遍观察到了类似的结构变化。 敲除或抑制OPA1:让耐药细胞“重新死亡” 为了验证OPA1的作用,研究者利用CRISPR-Cas9技术敲除了AML细胞中的OPA1基因。结果显示,缺失OPA1后,细胞对维奈克拉的敏感性显著提高,即使是已经产生耐药的细胞,也重新对药物产生反应。在小鼠实验中,OPA1缺失与维奈克拉联合治疗显著延长了白血病模型小鼠的生存期。 进一步地,研究团队开发并验证了两种小分子OPA1抑制剂——MYLS22和其改良版本Opitor-0。这两种药物可显著改变线粒体嵴的形态,使结构变得宽松,促进细胞色素c释放,重新激活凋亡通路。在多种AML细胞系及患者来源的异种移植模型(PDX)中,联合治疗均显示出强大的抗肿瘤协同效应,且对正常造血细胞影响较小,安全性较为理想。 双重打击:代谢脆弱性与铁死亡敏感性 研究不仅揭示了OPA1与凋亡逃逸的关系,还发现其抑制后,癌细胞代谢发生了明显变化。由于线粒体呼吸功能受损,AML细胞被迫转向依赖谷氨酰胺代谢以维持能量与抗氧化平衡。 在缺乏谷氨酰胺或使用谷氨酰胺酶抑制剂CB-839的情况下,这些细胞的生长显著受限。这一发现提示,OPA1抑制与代谢干预联合可能进一步增强治疗效果。 此外,OPA1抑制还会激活ATF4介导的整合应激反应,并上调多种与铁死亡(ferroptosis)相关的基因,如CHAC1。实验显示,使用铁死亡诱导剂Erastin时,MYLS22预处理可显著放大药效,使细胞出现更强的脂质过氧化反应,提示OPA1抑制+铁死亡诱导可能是未来值得探索的组合方案。 结语:靶向线粒体结构,或为AML治疗带来新曙光 本研究系统揭示了OPA1介导的线粒体重塑在AML耐药中的核心作用。从机制阐释到动物实验验证,结果一致表明:靶向OPA1不仅能恢复维奈克拉的疗效,还能暴露AML细胞的代谢与生存弱点。 作为潜在的联合治疗靶点,MYLS22与Opitor-0展现出良好的应用前景,尤其对于携带TP53突变等高危患者,或有望成为未来精准治疗的重要选择。 未来的研究或将进一步探索OPA1抑制与代谢调控、铁死亡诱导等多维联合策略,为攻克AML耐药提供新的思路与希望。2025-11-17
-
 我国首款痤疮治疗性疫苗获批临床试验,开启“青春痘”免疫治疗新纪元 2025年11月12日,威斯克生物携手四川大学华西医院联合研发的痤疮治疗性疫苗正式通过国家药品监督管理局(NMPA)临床试验(IND)审批,成为中国首个进入临床阶段的痤疮治疗性疫苗。这一突破性成果,标志着我国在皮肤免疫治疗领域迈出重要一步,也为全球痤疮患者带来了新的希望。 创新技术打造全球领先的痤疮治疗方案 这款由威斯克生物自主研发的重组蛋白疫苗基于先进的基因工程技术,靶向痤疮丙酸杆菌(Cutibacterium acnes)中致病型菌株特异性表达的关键毒力因子。通过蛋白结构优化,研究团队成功降低了毒性、提高了安全性,同时保留了强效的抗原性。 与传统治疗方式不同,该疫苗具有多项创新优势: 精准作用机制:仅针对致病性菌株,不破坏皮肤正常菌群,维持皮肤微生态平衡; 持久免疫效果:单次免疫即可形成长期保护,显著降低复发风险; 高效免疫反应:可诱导持续超过12个月的高滴度IgG抗体反应,有效中和毒力因子并促进巨噬细胞清除病菌。 非临床研究结果令人鼓舞 动物实验及早期非临床研究显示,该疫苗能够显著减少痤疮炎症反应与皮损面积,同时抑制致病菌的繁殖与定植。与市售常规药物相比,其防复发能力更强,且未出现明显的不良反应,显示出良好的安全性与耐受性。 疫苗适用人群及潜在优势 威斯克生物表示,这一创新疗法适用于多类痤疮高风险人群: 传统药物效果不佳或频繁复发者; 油脂分泌旺盛、激素波动明显的易感人群; 对抗生素耐药或不耐受者,想减少药物依赖的人群; 免疫系统反应过强、即使菌量低也易发作者。 相较于外用药和口服抗生素等传统方案,该疫苗不仅能避免长期用药带来的副作用,还可实现根源性预防,帮助患者重建皮肤健康屏障。 展望未来:从控制到治愈的新希望 痤疮长期以来被视为一种慢性炎症性疾病,传统治疗手段往往难以兼顾疗效与安全性。此次痤疮治疗性疫苗的获批临床,意味着我国在皮肤免疫治疗领域实现从“对症控制”到“免疫治愈”的跨越。 未来,随着临床研究的推进与数据积累,这一创新疫苗有望为数以亿计的青春痘患者提供安全、有效、持久的免疫解决方案,为全球痤疮治疗带来全新的范式转变。
我国首款痤疮治疗性疫苗获批临床试验,开启“青春痘”免疫治疗新纪元 2025年11月12日,威斯克生物携手四川大学华西医院联合研发的痤疮治疗性疫苗正式通过国家药品监督管理局(NMPA)临床试验(IND)审批,成为中国首个进入临床阶段的痤疮治疗性疫苗。这一突破性成果,标志着我国在皮肤免疫治疗领域迈出重要一步,也为全球痤疮患者带来了新的希望。 创新技术打造全球领先的痤疮治疗方案 这款由威斯克生物自主研发的重组蛋白疫苗基于先进的基因工程技术,靶向痤疮丙酸杆菌(Cutibacterium acnes)中致病型菌株特异性表达的关键毒力因子。通过蛋白结构优化,研究团队成功降低了毒性、提高了安全性,同时保留了强效的抗原性。 与传统治疗方式不同,该疫苗具有多项创新优势: 精准作用机制:仅针对致病性菌株,不破坏皮肤正常菌群,维持皮肤微生态平衡; 持久免疫效果:单次免疫即可形成长期保护,显著降低复发风险; 高效免疫反应:可诱导持续超过12个月的高滴度IgG抗体反应,有效中和毒力因子并促进巨噬细胞清除病菌。 非临床研究结果令人鼓舞 动物实验及早期非临床研究显示,该疫苗能够显著减少痤疮炎症反应与皮损面积,同时抑制致病菌的繁殖与定植。与市售常规药物相比,其防复发能力更强,且未出现明显的不良反应,显示出良好的安全性与耐受性。 疫苗适用人群及潜在优势 威斯克生物表示,这一创新疗法适用于多类痤疮高风险人群: 传统药物效果不佳或频繁复发者; 油脂分泌旺盛、激素波动明显的易感人群; 对抗生素耐药或不耐受者,想减少药物依赖的人群; 免疫系统反应过强、即使菌量低也易发作者。 相较于外用药和口服抗生素等传统方案,该疫苗不仅能避免长期用药带来的副作用,还可实现根源性预防,帮助患者重建皮肤健康屏障。 展望未来:从控制到治愈的新希望 痤疮长期以来被视为一种慢性炎症性疾病,传统治疗手段往往难以兼顾疗效与安全性。此次痤疮治疗性疫苗的获批临床,意味着我国在皮肤免疫治疗领域实现从“对症控制”到“免疫治愈”的跨越。 未来,随着临床研究的推进与数据积累,这一创新疫苗有望为数以亿计的青春痘患者提供安全、有效、持久的免疫解决方案,为全球痤疮治疗带来全新的范式转变。2025-11-14
大家都在看
-
1
荣灿生物获美国专利授权,助力mRNA药物研发新突破
-
2
罗伯医疗获批消化内镜手术机器人,填补国内技术空白
-
3
中国首个IGF-1R抗体药物获批上市,甲状腺眼病治疗迎来新曙光
-
4
广州润尔眼科盐酸依匹斯汀滴眼液获批上市,国内首仿迎来市场竞争新机遇
-
5
孤独症的早期识别与干预:帮助“星星的孩子”走向更好的未来
-
6
微型心脏起搏器的革新:为新生儿和儿童提供更安全的治疗
-
7
重大发现:朊病毒或成胶质母细胞瘤治疗新靶点
-
8
Bright Uro创新发布无导管尿动力学监测系统Glean,获FDA批准
-
9
华东医药司美格鲁肽申报上市,国产GLP-1迎来新突破
-
10
季节性过敏性鼻炎迎来新突破:创新疗法Stapokibart或成新选择
药品推荐
-

来曲唑 Letrozole
联合治疗晚期乳腺癌中位生存63.9个月,延长随访时间
瑞士诺华制药
-

左旋炔诺酮 levonorgestrel
适用于口服避孕
美国辉瑞公司(Pfizer Inc.)
-
达必妥 Dupilumab
全球首个也是唯一获批治疗成人中重度特应性皮炎的靶向生物制剂,可从机制上治疗2型炎症性疾病。
法国Sanofi-Aventis赛诺菲公司
-
urovaxom Escherichia coli Lysat
用于联合治疗和预防慢性尿路感染,特别是膀胱炎,本品主要用于治疗和预防4岁以上的反复尿路感染
瑞士OM Pharma
-
他莫昔芬 Tamoxifen
用于卵巢癌、乳腺癌等,降低侧乳腺癌发生率
土耳其Deva


