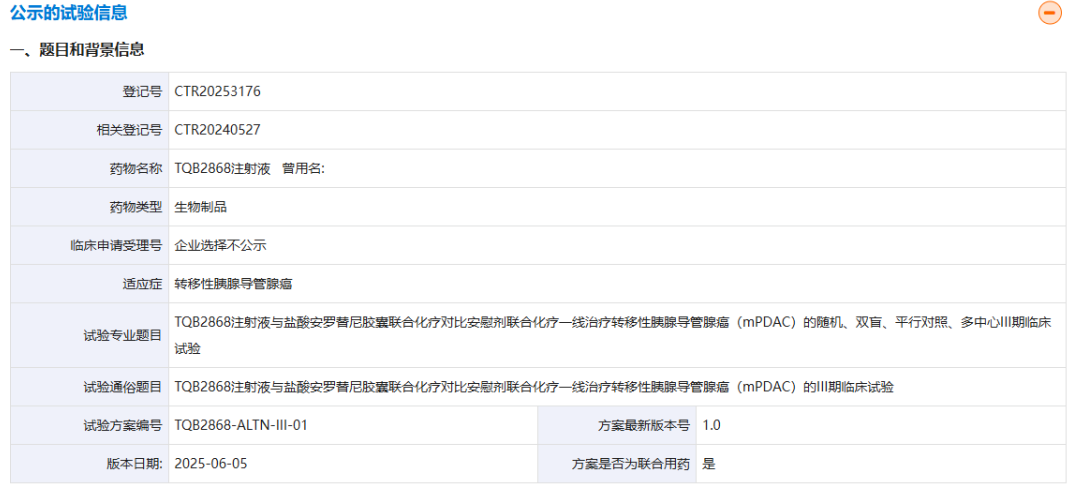
近日,中国科学院合肥物质科学研究院杨武林研究员带领的科研团队在肝细胞癌(Hepatocellular Carcinoma, HCC)研究中取得重要突破。团队揭示了肝癌与正常肝组织在代谢机制上的本质差异,并发现通过同时靶向特定代谢酶与补充维生素A衍生物,可显著提升肝癌抑制效果,为临床治疗带来新的可能。
肝癌与肝再生的代谢差异成为研究关键
肝脏具备强大的再生能力,但肝细胞癌的恶性生长与正常肝组织修复存在显著差异。传统的靶向药物虽然能延缓病情,却常因耐药性和副作用限制疗效。针对这一问题,科研团队系统比对了肝癌细胞与良性再生肝细胞的基因表达谱,找出了六种在代谢活动中异常活跃的关键酶。
这些酶促使癌细胞快速制造蛋白质、脂质等大分子物质,从而维持其高速度的分裂与扩张。其中,ATP柠檬酸裂解酶、葡萄糖-6-磷酸脱氢酶、胸苷酸合成酶三者被确定为代谢通路的上游“核心驱动点”,是抑制肝癌的理想靶标。
视黄酸代谢障碍揭示肿瘤干细胞的新弱点
进一步研究发现,肝癌细胞的视黄醇(维生素A)代谢路径受阻,导致视黄酸的生成显著下降。而视黄酸正是抑制肿瘤干细胞自我更新的重要分子。该机制的缺陷意味着肝癌细胞失去了一个天然的“刹车系统”,从而获得了持续生长的能力。
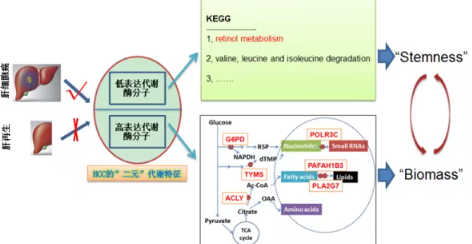
“代谢酶抑制剂+视黄酸”双靶联合疗法效果显著
基于上述机制,研究团队提出一种全新的联合疗法策略:在阻断癌细胞能量代谢的同时,恢复被削弱的视黄酸信号。实验采用特异性代谢酶抑制剂联合视黄酸干预,结果显示该疗法能在体外显著抑制肝癌细胞增殖,并在动物实验中展现出超过临床药物索拉非尼的抗肿瘤效果。
这一组合方案实现了从“阻止细胞生长”到“阻断癌细胞再生”的双重打击,为传统单靶点药物难以解决的耐药性问题提供了新思路。
打通代谢网络精准治疗新路径
该研究成功突破了以往针对单一代谢靶点的局限,通过系统性干预癌细胞的代谢网络,为多维度精准治疗提供了科学依据。研究成果不仅为肝癌治疗提供了新的药物组合模式,也为其他代谢异常相关癌症研究树立了新的研究范式。
相关成果已发表于国际权威期刊《International Journal of Biological Macromolecules》(《国际生物大分子杂志》)。