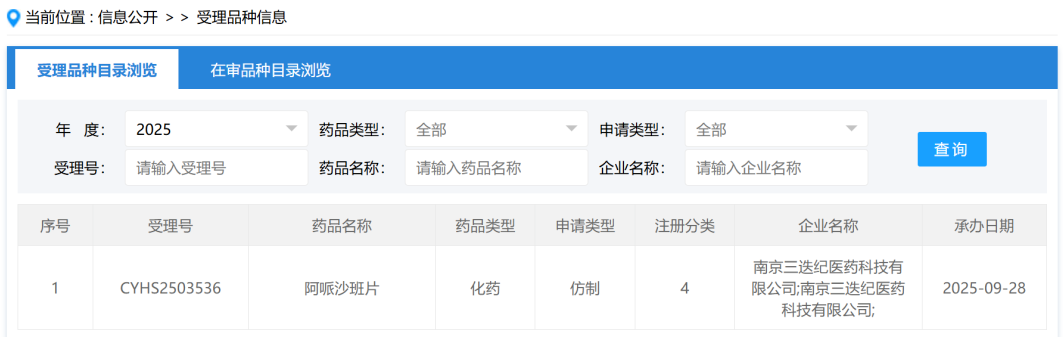
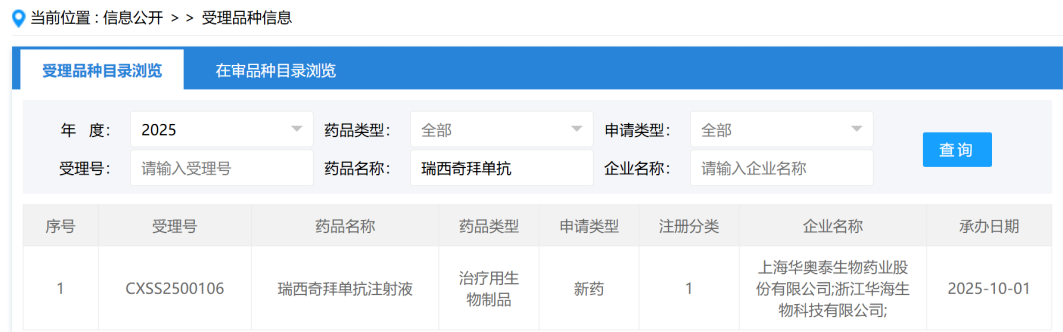
乳腺癌是发生脑转移风险最高的癌症之一,其中HER2阳性乳腺癌患者尤为显著,脑转移率高达30%-50%。由于乳腺癌脑转移的分子机制了解有限,治疗手段匮乏,患者预后非常差。近日,美国克利夫兰诊所的Chen
Peiwen团队在《Cancer
Research》上发表了一项重要研究,揭示了肿瘤相关小胶质细胞内的TBK1信号通路在乳腺癌脑转移中的关键作用,为靶向TBK1的药物开发提供了新的理论依据。 小胶质细胞与乳腺癌脑转移的关联 乳腺癌脑转移通常伴随肿瘤相关小胶质细胞的异常激活。小胶质细胞是大脑中的主要免疫细胞,在肿瘤微环境中被“教育”成为肿瘤相关小胶质细胞,促进乳腺癌细胞的定植和增殖。然而,肿瘤相关小胶质细胞具体如何影响乳腺癌脑转移,仍是未解的谜题。 Chen Peiwen团队的研究聚焦于TBK1(TANK结合激酶1),后者是调控小胶质细胞功能的关键分子,在乳腺癌脑转移中可能发挥重要作用。 实验解析:TBK1的关键作用 研究团队通过一系列体外和体内实验,系统验证了肿瘤相关小胶质细胞内TBK1信号通路对乳腺癌细胞的迁移、侵袭和增殖的重要影响: 1. 体外实验:TBK1促进乳腺癌细胞EMT 将乳腺癌细胞培养基处理的小胶质细胞,与乳腺癌细胞共培养后,检测乳腺癌细胞的上皮-间质转化(EMT)。 结果显示,肿瘤相关小胶质细胞显著促进乳腺癌细胞EMT,而抑制TBK1能够显著降低这一现象。 2. 小胶质细胞调控迁移和侵袭能力 肿瘤相关小胶质细胞通过TBK1信号激活,增强乳腺癌细胞的迁移和侵袭能力。 体内实验发现,使用TBK1抑制剂处理小胶质细胞后,乳腺癌细胞迁移和侵袭显著减少,但不影响癌细胞存活率。 下游机制探索:GM-CSF在脑转移中的作用 研究进一步揭示了TBK1信号通路的下游机制: 1. GM-CSF上调是关键 通过转录组分析发现,肿瘤相关小胶质细胞内TBK1激活后,编码粒细胞-巨噬细胞集落刺激因子(GM-CSF)的基因CSF2表达显著上调。GM-CSF可促进乳腺癌细胞的EMT、迁移、侵袭和增殖。 2. 双向验证GM-CSF功能 敲低小胶质细胞中的CSF2基因后,其处理的乳腺癌细胞未表现迁移与侵袭特性; 耗竭乳腺癌细胞表面的GM-CSF受体CSF2RA后,GM-CSF无法再诱导乳腺癌细胞的侵袭和增殖,证实GM-CSF在乳腺癌脑转移中的重要功能。 体内实验:TBK1抑制剂减少脑转移 在乳腺癌脑转移小鼠模型中,研究团队进一步验证了TBK1抑制剂的效果: 减少脑转移病灶:抑制TBK1后,乳腺癌的脑转移部位显著减少; 延长生存期:使用TBK1抑制剂的小鼠表现出更长的生存时间; 控制病变生长:对于已发生脑转移的小鼠,TBK1抑制剂能够显著阻止脑内转移灶的进一步生长。 这些结果进一步确认了TBK1在乳腺癌脑转移中的治疗潜力。 未来方向与临床意义 这项研究发现,肿瘤相关小胶质细胞的TBK1信号通路是乳腺癌脑转移的关键分子。通过靶向TBK1,不仅能抑制乳腺癌脑转移,还能延长患者生存期,为乳腺癌治疗提供了新方向。 临床意义: 潜在治疗探索:已有TBK1抑制剂获批上市,临床用途为抗炎抗过敏。这种药物的现有安全性数据将加速其在乳腺癌治疗中的临床试验。 肿瘤微环境研究:乳腺癌如何“教育”小胶质细胞成为肿瘤相关小胶质细胞,仍需进一步探索,以实现肿瘤微环境的全面调控。 总结 克利夫兰诊所Chen
Peiwen团队的研究突破了乳腺癌脑转移机制的瓶颈,揭示了肿瘤相关小胶质细胞的TBK1信号通路如何通过GM-CSF促进乳腺癌细胞的EMT、侵袭和转移。这一发现为开发靶向TBK1的乳腺癌治疗提供了有力支撑,同时为乳腺癌脑转移研究开辟了新的路径,为更多患者带来希望。未来,伴随药物研发与肿瘤微环境研究的持续推进,乳腺癌脑转移的临床治疗有望迎来新的突破。