肝癌是全球范围内难以攻克的重大健康问题。据世界卫生组织数据,2022年全球新发肝癌病例达86万例,其中死亡人数高达78万。尤其是在中国,肝癌常年位列癌症死亡原因的第二位,患者平均五年生存率仅为14%。
对无法手术切除的早期肝癌患者而言,热消融是临床中的常用治疗方式——通过探针加热肿瘤局部至60-100℃,以高温“烧死”癌细胞。然而,约40%的患者术后仍出现肿瘤复发,癌细胞竟能在亚致死高温区存活并卷土重来。这种现象引发了研究者的广泛关注。
近日,发表在《Hepatology》上的一项研究揭示了这一复发谜团的核心:一种名为Galectin-1(Gal-1)的关键蛋白似乎充当了癌细胞的“糖保镖”,通过为其提供能量“续命”助其熬过高温。研究发现,联合使用Gal-1抑制剂或能显著增强热消融的疗效,有望成为肝癌治疗的突破口。

Gal-1:热消融边缘区的抗癌之谜
非应答患者中Gal-1显著升高
为了探明肝癌复发的机制,加州大学的研究团队分析了58份早期肝癌穿刺样本,其中包括:
32例应答者(2年内无病程进展);
23例非应答者(2年内出现复发)。
研究通过无偏蛋白质组学技术(MSFragger软件进行蛋白鉴定),发现非应答患者标本中有一种异常显著的信号——Gal-1蛋白强烈升高!
进一步的组织检测证实:非应答者的肿瘤组织中,Gal-1阳性细胞数量是应答者的数倍,而健康肝组织中Gal-1几乎不表达。这提示,Gal-1或许是癌细胞抵抗热消融的幕后推手。
Gal-1如何成为癌细胞的“保镖”?
模拟亚致死高温区
为了验证Gal-1的作用,研究团队在体外模拟了热消融边缘“亚致死高温环境”。他们将两种肝癌细胞(SNU449和SNU423)暴露在47℃水浴25分钟(15分钟平衡+10分钟处理)。
结果显示:
Gal-1高表达的SNU449细胞死亡率远低于低表达的SNU423细胞;
同时,SNU449仍能在高温处理后快速增殖,展现强烈的抗性。
Gal-1为癌细胞“续命供能”
研究进一步揭示了Gal-1的分子机制:通过调控细胞代谢网络,它为癌细胞提供持续的能量支持。其具体步骤如下:
拆解“糖仓库”:
Gal-1与GM1神经节苷脂结合,招募**β-半乳糖苷酶(β-gal)**将GM1水解为半乳糖;
激活能量链:
半乳糖通过Leloir途径转化为葡萄糖-6-磷酸,进入糖酵解途径及三羧酸循环(TCA cycle),最终生成大量ATP。
分子桥梁调控:
高温下,Gal-1通过与P-糖蛋白的N端(N-P-gp)形成复合物,同时受**O-糖基化(O-GlcNAcylation)**调节,进一步加速半乳糖代谢并提升细胞能量供应。
联合抑制剂:进一步提升治疗效果
细胞和小鼠实验提供积极信号
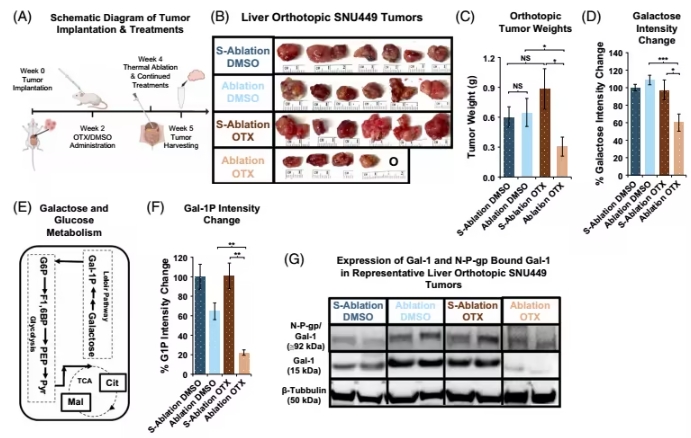
为了增强热消融效果,研究团队尝试联合使用Gal-1抑制剂(OTX008),结果显示:
细胞实验:
用OTX008处理后,47℃高温下SNU449细胞死亡率从20%升至60%,同时糖酵解活性显著下降(降低约50%);
小鼠模型:
在移植肿瘤的裸鼠中,联合注射OTX008后,肿瘤体积仅为单独热消融组的1/2,且肿瘤内半乳糖代谢物(如半乳糖-1-磷酸)和ATP水平显著降低。
此外,OTX008已经在晚期结直肠癌患者的临床试验中证实其安全性,具有每日皮下注射65mg无严重毒副作用的特点,为临床应用奠定基础。
Gal-1:多癌种治疗的通用靶点
研究还指出,Gal-1不仅在肝癌中发挥“护癌”作用,在胰腺癌、肺癌等多个癌种中也同样通过调控代谢或免疫逃逸促进肿瘤发展。这提示,Gal-1抑制剂可能增强其他热消融、放疗及免疫治疗的效果。
例如,免疫治疗中,Gal-1会通过上调PD-1/PD-L1通路导致耐药,联合Gal-1抑制剂有望克服这一难题,释放免疫疗法潜力。
总结:精准破局,抗癌新路径
这项研究首次揭示了肝癌热消融后复发背后的核心机制:Gal-1通过糖代谢为癌细胞提供能量支持,是关键的“护盾”和“雷管”。联合使用Gal-1抑制剂OTX008,有望显著降低热消融复发率,为晚期肝癌患者提供全新治疗选择。
未来,临床医生或许只需在热消融术前加一步“Gal-1抑制剂静脉注射”,就能让癌细胞失去能源保护,实现从“物理杀伤”到“代谢干预”的精准抗癌新路径。