11月7日,华辉安健宣布,公司将在即将召开的第76届美国肝病研究协会(AASLD)年会上,以最新突破性摘要(Late-Breaking Abstract)口头报告的形式,公开展示自主研发的立贝韦塔单抗(HH-003)在慢性丁型肝炎病毒(HDV)感染治疗中的关键注册Ⅱb期临床试验(HH003-204)48周疗效数据。这一消息标志着该药物在全球丁肝治疗领域取得了又一重要进展。
PreS1单抗创新机制:阻断HDV感染新路径
立贝韦塔单抗(HH-003)是由华辉安健自主研发的乙肝/丁肝病毒PreS1单克隆抗体。该药物通过高特异性结合乙肝与丁肝病毒表面的PreS1区域,阻止病毒与其宿主受体NTCP的结合,从而有效抑制病毒进入肝细胞,实现阻断初次感染与再感染的双重防护。
这一独特的作用机制使HH-003成为全球首批针对HDV感染的创新型抗体药物之一。目前,该药物已被中国国家药品监督管理局(NMPA)列入突破性治疗品种名单,并获得美国FDA授予的突破性疗法(BTD)认定。其针对慢性HDV感染的新药上市申请(NDA)已于2024年12月正式被中国药审中心(CDE)受理。
HH003-204研究设计与临床结果
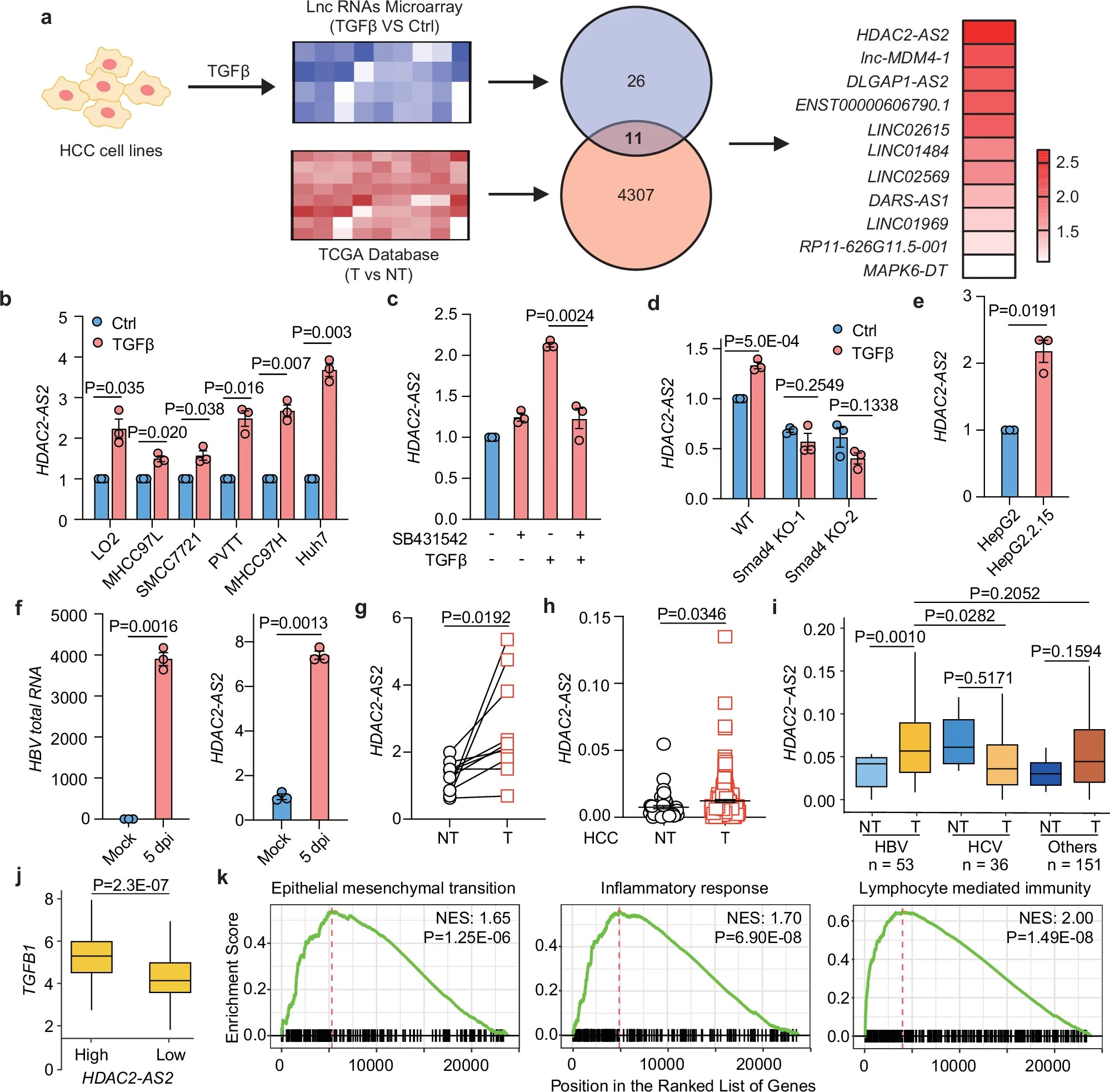
HH003-204是一项国际、多中心、随机、对照、开放标签的Ⅱb期临床研究,旨在评估立贝韦塔单抗在慢性HDV感染患者中的疗效与安全性。研究主要终点为复合应答率,即治疗24周时患者的HDV RNA降至检测下限(LLOQ)以下或较基线降低≥2 log10,同时血清ALT水平恢复正常的比例。
研究结果显示,立贝韦塔单抗在多个关键疗效指标上均表现出显著优势:
复合终点应答率显著提高,优于对照组;
HDV RNA显著下降,显示出强劲的病毒学抑制作用;
ALT水平明显恢复正常,提示肝功能显著改善;
肝脏硬度明显下降,显示长期抗炎及抗纤维化潜力。
此外,在48周的治疗周期内,立贝韦塔单抗各剂量组均表现出良好的耐受性与安全性,未观察到新的严重不良事件。
全球关注:丁肝治疗领域的潜在“破局者”
华辉安健方面表示,立贝韦塔单抗在Ⅱb期临床研究中的积极成果为后续注册及商业化奠定了坚实基础。随着该药物即将在AASLD 2025年会上公开详细数据,业内普遍期待其成为首个可有效阻断HDV感染的创新抗体疗法,为全球数百万丁肝患者带来新的治疗希望。
总结
立贝韦塔单抗(HH-003)以其独特的PreS1靶向机制和优异的临床表现,在慢性丁肝治疗领域展现出强大潜力。其即将在AASLD 2025年会上公布的48周临床数据,将进一步验证其作为突破性疗法的临床价值,也为未来丁肝治疗格局的重塑提供了新的契机。