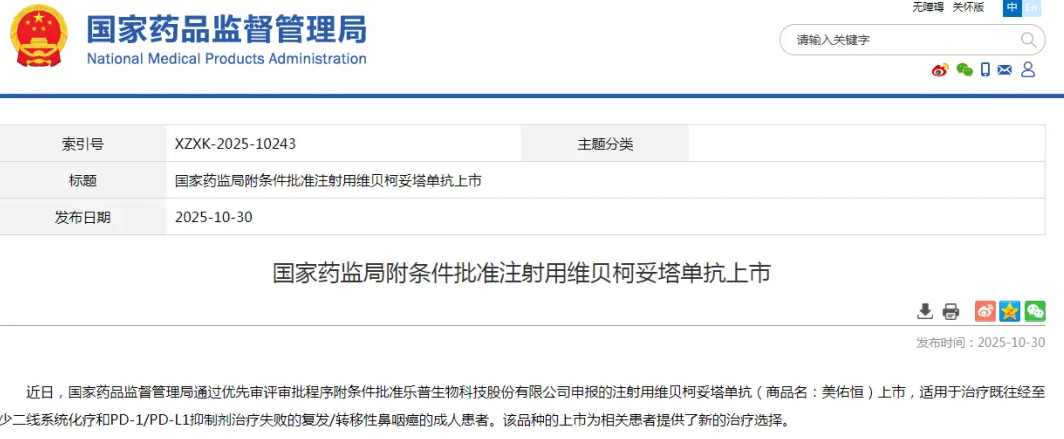
CLDN18.2是一种在非恶性胃上皮中表达的紧密连接蛋白,在胃癌或胃食管结合部腺癌恶性转化过程中,其靶点暴露于肿瘤细胞表面,因此被视为一种潜在的治疗靶点。近日,中山大学肿瘤防治中心徐瑞华教授团队在《Nature Medicine》发表了关于恒瑞医药开发的CLDN18.2-抗体药物偶联物(ADC) SHR-A1904 的首个人体(first-in-human)1期临床试验数据,取得突破性进展。

SHR-A1904:靶向CLDN18.2的创新型ADC药物
SHR-A1904 是由恒瑞医药自主研发的抗体-药物偶联物(ADC),该药物结合了 抗-CLDN18.2单克隆抗体、拓扑异构酶I抑制剂作为有效载荷,以及可裂解的肽键连接子。其设计目标在于专门针对CLDN18.2阳性的晚期胃癌或胃食管结合部腺癌患者,提供高效精准的靶向治疗。
临床研究:1期试验覆盖广泛人群
在这项研究中,研究团队对95名既往接受过治疗的CLDN18.2阳性晚期患者进行了评估。这项1期临床试验采用剂量递增设计,剂量范围为0.6–8.0mg/kg。
在剂量递增阶段,发现4.8 mg/kg的两名患者出现了 剂量限制性毒性(DLTs),包括3级发热性中性粒细胞减少症及3级胆红素升高;而在6.0mg/kg组一名患者出现3级胃黏膜损伤。不过,该研究并未达到最大耐受剂量(MTD),最终选择6.0mg/kg 和8.0mg/kg 作为后续研究剂量。
安全性:大部分不良事件为可控范围
试验结果表明,95名受试者均经历了治疗相关的不良事件,常见副作用包括 贫血(75.8%)、恶心(67.4%)、低白蛋白血症(64.2%) 及白细胞计数下降(58.9%)。药物相关的3级或更高级不良事件发生率为62.1%,但未观察到治疗相关死亡案例。这表明,该药物呈现良好的安全性和耐受性。
疗效数据:中位无进展生存期接近6个月
在疗效上,SHR-A1904的表现令人鼓舞。6.0mg/kg 剂量组确认的客观缓解率(ORR)为24.2%,8.0mg/kg 剂量组为25.0%。此外,两组的中位无进展生存期(PFS)分别为5.6个月和5.8个月。这些数据表明,该药物在治疗上具有抗肿瘤活性基础,为后续研究奠定了良好基础。
意义与展望:靶向CLDN18.2的突破性进展
此次研究由中山大学肿瘤防治中心徐瑞华教授团队领衔,首次在人类中实现了 SHR-A1904 的临床评估。研究表明,该药物在治疗CLDN18.2阳性胃癌患者中安全性可控,疗效值得期待。这一研究结果为该靶点ADC药物的进一步开发和应用提供了重要依据,对难治型胃癌的患者无疑是一大福音。
研究团队:汇聚多方力量,推动中国研发
本研究由徐瑞华教授和邱妙珍教授共同牵头,阮丹云医生、吴灏祥医生、罗素霞医生及黄文雯医生为该论文的共同第一作者。团队依托中山大学肿瘤防治中心,与多方力量协作,推进了该药物的早期研发。这项成果凸显了中国科学家在全球癌症领域科学研究的硬实力。
总之,SHR-A1904的1期研究结果表明,针对此类患者的CLDN18.2靶向疗法具有可控安全性和积极的抗肿瘤效果,下一步可能是开展更大规模的后续临床试验,为其最终用药价值奠定坚实基础。