2025年8月25日,贝达药业发布公告称,其自主创新药恩沙替尼在间变性淋巴瘤激酶(ALK)阳性的非小细胞肺癌(NSCLC)术后辅助治疗的III期临床试验中取得积极进展。根据临床试验独立数据监查委员会(IDMC)的评估,每期中分析显示该试验达到了预设的主要终点,并获得了显著统计学意义和重要临床益处。贝达药业正紧张准备申报材料,力争快速提交新增适应症的药品上市许可申请(NDA)。
III期临床试验背景与主要发现
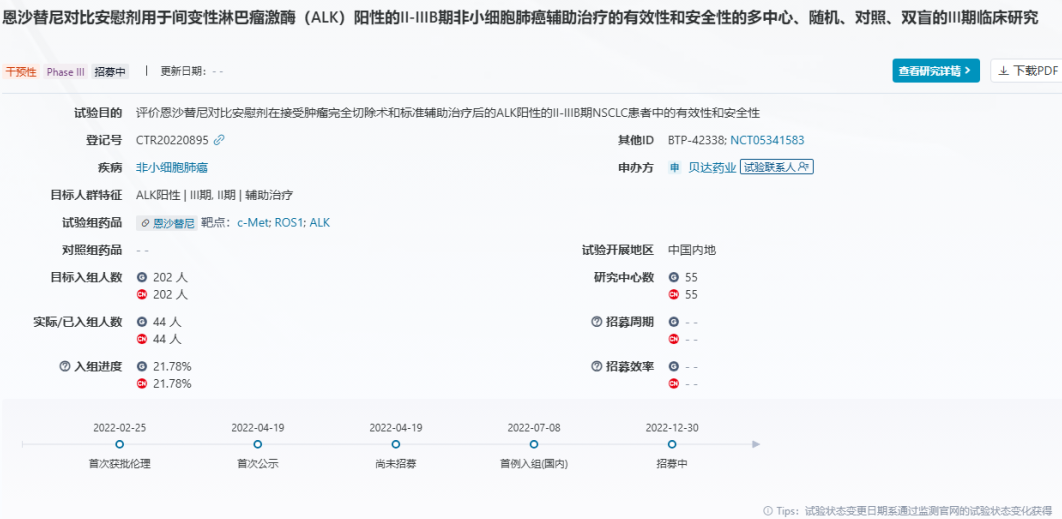
此次恩沙替尼术后辅助治疗III期临床试验(CTR20220895/NCT05341583)于2022年4月首次宣布启动,旨在评估恩沙替尼对比安慰剂治疗接受肿瘤完全切除术和标准辅助治疗后的ALK阳性的II-IIIB期非小细胞肺癌(NSCLC)患者的安全性和有效性。试验的主要终点是患者的无病生存期(DFS)。期中分析结果显示,恩沙替尼组在该终点上表现优异,显著优于安慰剂组。同时,数据还表明其具有重要的临床获益,有望为ALK阳性NSCLC患者术后辅助治疗带来更优疗效选择。
恩沙替尼:新一代强效ALK靶向抑制剂
恩沙替尼是一款新型、高选择性的新一代ALK抑制剂,由贝达药业及其控股子公司Xcovery联合开发。作为自主创新药,恩沙替尼在全球多个市场的拓展中不断展现其强效的治疗优势。
首次获批(2020年11月):恩沙替尼获批用于此前接受过克唑替尼治疗后进展或对克唑替尼不耐受的ALK阳性的局部晚期或转移性NSCLC患者(二线适应症)。
一线适应症(2022年3月):NMPA批准恩沙替尼用于治疗ALK阳性的局部晚期或转移性NSCLC患者。
在国际化进程中,恩沙替尼也取得了重要进展:
美国上市(2024年12月):恩沙替尼一线适应症获得美国食品药品监督管理局(FDA)批准上市。
欧洲申报(2025年2月):恩沙替尼正式启动一线适应症的欧洲上市申报程序,并显示出强劲的全球商业化潜力。
临床与市场意义:术后辅助治疗的突破
此次试验结果的公布,进一步扩展了恩沙替尼的治疗范围,将其从晚期及转移性NSCLC的治疗拓展至术后辅助治疗领域。在ALK阳性NSCLC患者中,尽管已有切除术及辅助治疗手段,但术后复发风险仍较高,无病生存期的延长对提升患者整体预后至关重要。通过恩沙替尼的作用,可有效抑制术后肿瘤复发,显著改善患者的长期生存获益。这项突破不仅完善了恩沙替尼的治疗路径,也为患者提供了全新的术后管理方案。
未来展望:全球化布局加持市场潜力
恩沙替尼作为贝达药业核心产品,其积极的临床试验数据不仅彰显了药物研发实力,也进一步巩固了其市场地位。通过全球化布局,恩沙替尼已经持续渗透多个市场,在国内产品扩展的基础上,通过FDA及欧洲申报加速抢占国际市场,展现出极大的商业化潜力。贝达药业此次新增适应症的申报工作进展迅速,未来有望在术后辅助治疗领域占据重要地位,拓展临床应用空间,为更多ALK阳性NSCLC患者带来长久获益。
总结
恩沙替尼术后辅助治疗III期临床试验的阳性结果,不仅标志着其在ALK阳性NSCLC治疗上取得又一关键突破,也进一步丰富了其临床应用场景。凭借强效的肿瘤抑制作用及全球化布局战略,恩沙替尼将为卵巢癌患者带去更多生存希望,同时助力贝达药业不断提升国际竞争力,走向全球创新药领域的新高峰。