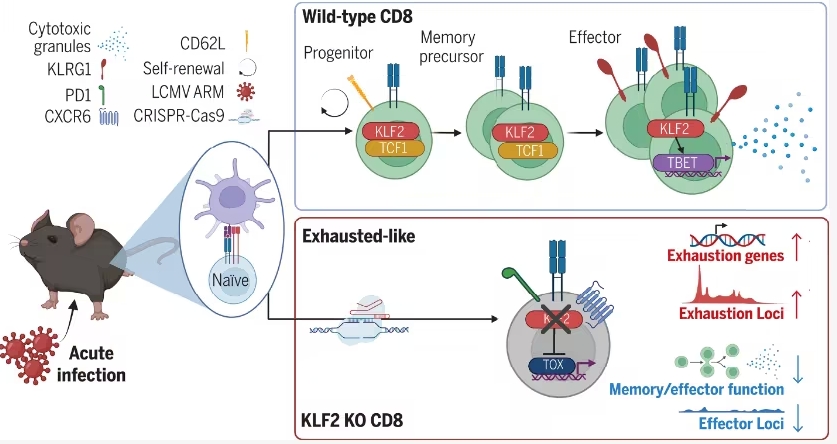
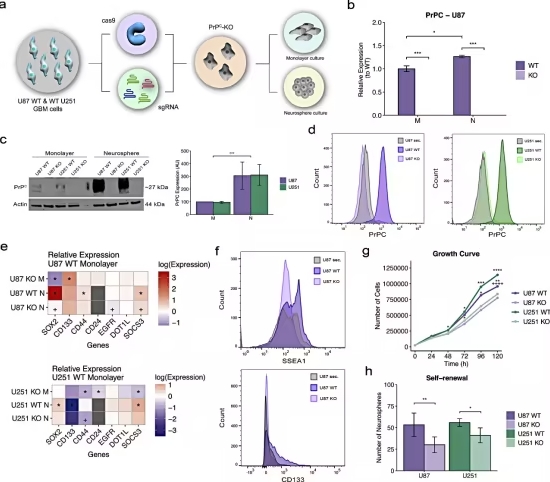
2025年8月25日,信达生物正式宣布,其自主研发的PD-1/IL-2α-bias双特异性抗体融合蛋白IBI363的首个全球3期临床研究(MarsLight-11)的新药临床试验申请(IND)获美国FDA批准,适用于治疗免疫耐药的鳞状非小细胞肺癌(NSCLC)患者。这一审批通过标志着信达生物在双免疫疗法全球开发的重大进展,同时进一步巩固了IBI363在国际市场的创新地位。
IND获批,推动全球肺癌临床试验全面启动
本次IND批准基于信达生物与美国FDA召开的一次关键性EOP2会议,会议得到了监管机构对于计划研究的积极反馈,明确了3期临床研究的关键方案,包括治疗剂量和研究设计等内容。此前,该适应症的IBI363 IND申请也已获得中国国家药品监督管理局(NMPA)的批准,并被授予突破性治疗药物(BTD)认证,同时取得美国FDA的快速通道资格(FTD)。这些批准为IBI363推进全球布局打下了坚实的基础。
MarsLight-11研究将是一项覆盖多区域的大型随机对照3期临床试验,计划在包括中国、美国、日本、欧盟、英国和加拿大等国家和地区招募约600名患者,主要研究目标集中于评估IBI363单药(3 mg/kg剂量)与化疗标准药物多西他赛(docetaxel)在治疗经铂类化疗及PD-1/PD-L1治疗进展后的不可手术切除的局部晚期或转移性鳞状非小细胞肺癌患者中的疗效和安全性。试验核心终点为总生存期(OS),这一研究结果将为IBI363的注册申请提供重要支撑。
ASCO 2025数据展现双免疫激活潜力,多项研究覆盖多瘤种
在2025年美国临床肿瘤学会年会(ASCO 2025)上,IBI363的1/2期临床研究数据作为口头报告亮相,并展示了其在多种免疫耐药及“冷肿瘤”(免疫反应较弱肿瘤)中的良好临床效果,覆盖非小细胞肺癌、结直肠癌及黑色素瘤等适应症。数据显示,IBI363能够通过激活免疫系统(PD-1通路阻断及IL-2α选择性激活),产生显著的抗肿瘤免疫反应,并取得了长期生存获益。

黑色素瘤:多措并举进入注册阶段
在黑色素瘤领域,IBI363关键注册临床研究已经开展,并显示出理想的疗效数据,为该适应症的上市奠定了基础。
鳞状非小细胞肺癌:即将开启全球3期研究试验
IBI363在MarsLight-11临床试验中的应用,将进一步探索其在全球范围内的治疗潜力,如成功递交,将为肺癌患者带来全球创新治疗选择。
结直肠癌:推进全面注册临床规划
在结直肠癌适应症中,信达生物正计划与监管部门进行沟通,推动IBI363进入注册临床研究阶段。
丰富管线布局:单药与联合治疗并行
基于其突破性疗效,IBI363的研发策略覆盖多个领域,目前多项1b/2期临床试验正在探索其在不同瘤种中的应用,包括:
非小细胞肺癌(NSCLC)一线治疗;
一线结直肠癌(CRC)治疗;
铂类耐药卵巢癌(PROC);
EGFR阳性NSCLC及非鳞状NSCLC的新辅助治疗。
通过单药疗法及联合疗法的双线研发,信达生物正在构建IBI363的全面临床应用蓝图,提升其在全球市场中的竞争力。
信达生物加码全球创新,推动肿瘤免疫疗法新时代
此次IBI363首个全球随机对照3期临床研究的IND获批,不仅体现了双免疫疗法的重大创新潜力,更显现了信达生物在拓展国际市场和推进药物开发上的雄厚实力。随着IBI363在多瘤种布局的稳步推进及全球临床试验的启动,这一突破性药物有望打破免疫耐药的治疗瓶颈,为包括肺癌、结直肠癌及黑色素瘤在内的患者提供更持久、高效的治疗方案。
未来,信达生物将继续致力于通过创新技术研发,为全球癌症患者提供更优质的治疗选择,同时推动中国药企在国际市场上的影响力提升。IBI363的成功或将引领下一代肿瘤免疫疗法新潮流,让更多患者从中获益。