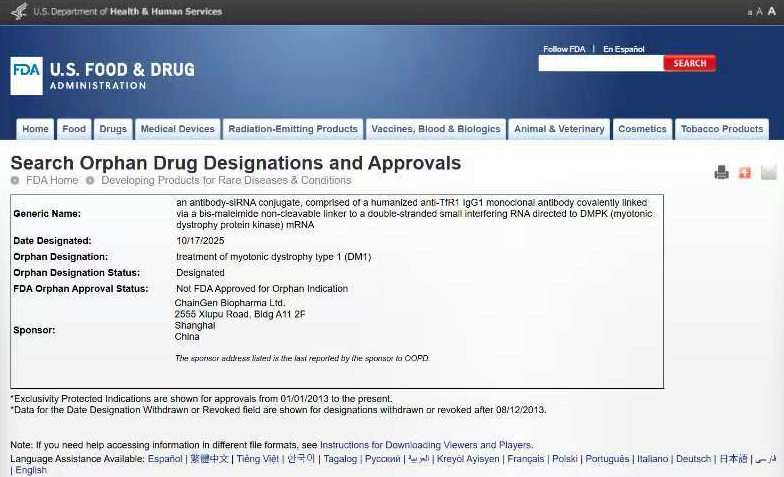
2025年10月17日,融汇Family旗下成员企业——迦进生物医药(上海)有限公司宣布,其自主研发的TfR1抗体-人DMPK siRNA偶联药物CGB1001成功获得美国食品和药物管理局(FDA)授予的孤儿药资格认定(Orphan Drug Designation, ODD),用于治疗1型强直性肌营养不良(DM1)。这一里程碑事件标志着中国创新药物在罕见病领域迈出关键一步。
DM1:全球最常见的成人型肌营养不良
强直性肌营养不良(DM)是遗传性神经肌肉疾病中最常见的一类,其中1型强直性肌营养不良(DM1)为主要亚型。该病的典型表现包括四肢远端肌肉无力和萎缩,并伴有明显的肌强直症状。目前国际上对其发病机制已有较深入研究,但尚缺乏特异性和有效的治疗手段,患者主要依赖对症治疗。
国际研发格局与国内空白
在全球范围内,已有如Avidity Biosciences与Dyne Therapeutics等生物科技公司正针对DM1开展siRNA或寡核苷酸药物的临床研究。然而,国内尚未有企业在该领域实现实质性突破。
迦进生物作为中国最早布局抗体-RNA偶联(ARC)药物研发的企业之一,凭借多年的技术积累,成功研制出CGB1001,填补了国内在DM1寡核苷酸治疗药物领域的空白。
CGB1001:临床前成果显著
CGB1001在研发过程中已顺利完成体外实验、小鼠及非人灵长类动物的临床前研究,并取得了积极的疗效和安全性数据。其独特的TfR1抗体递送机制能够高效将siRNA精准输送至靶组织,提高药物作用效率并降低潜在副作用。
FDA孤儿药认定的意义
美国FDA的孤儿药资格认定,主要面向罕见病或患者人数少于20万的疾病。
获得ODD资格后,药物研发企业可享受包括:
临床试验费用税收减免
新药上市后7年市场独占权
FDA提供的技术指导与加速审批通道 等一系列政策支持。
这意味着CGB1001不仅在科学层面得到国际认可,也将在商业化与全球注册路径上获得更多机遇与资源。
未来展望
迦进生物表示,公司将以此次孤儿药认定为契机,加速CGB1001的临床推进与全球合作,推动其早日惠及患者。未来,企业将持续深耕ARC药物平台,拓展更多罕见病及神经肌肉疾病治疗方向,为中国创新药物走向国际市场贡献力量。
结语
CGB1001获FDA孤儿药认定,不仅代表了中国创新药物在罕见病领域的国际认可,也预示着DM1治疗将迎来全新突破。随着后续临床推进,这一创新疗法有望为全球DM1患者带来切实的希望。