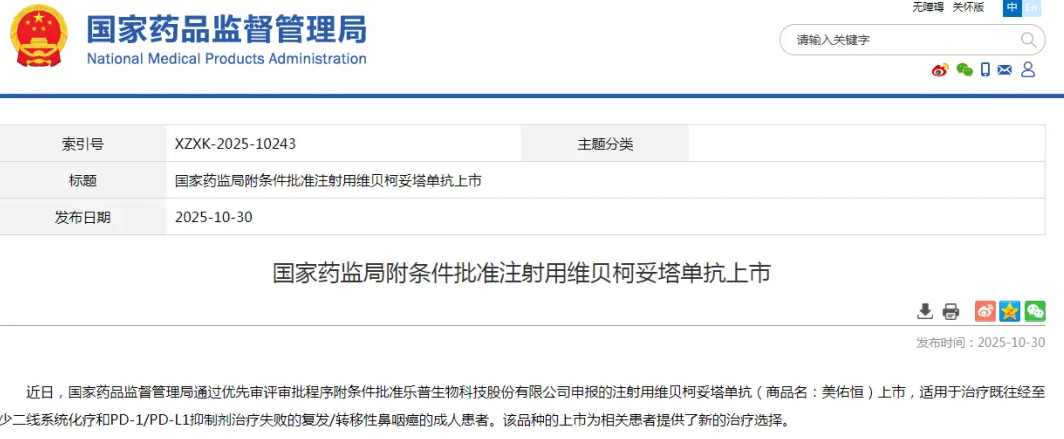
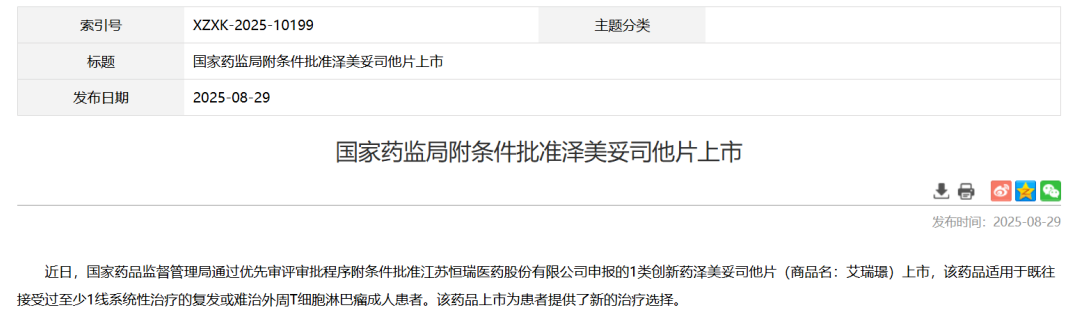
线粒体是细胞的能量工厂,承担着能量代谢、产热、离子平衡和细胞存活等重要功能。线粒体的质子动力势(proton motive force)由电位梯度(∆ψm)和化学梯度(∆pH)组成,这一过程对 ATP 合成、细胞代谢、钙稳态以及活性氧(ROS)的生成至关重要。然而,质子动力势的异常会导致多种疾病的发生,包括神经退行性疾病(如帕金森病和阿尔茨海默病)、糖尿病、癌症及衰老等。尽管质子动力势在健康和疾病中占据重要地位,但针对其恢复的有效治疗方法仍较为匮乏。
最新研究:环境光激活线粒体缓解视网膜神经退行性病变
在2025年10月30日,郑州大学的康建胜教授团队与复旦大学的张嘉漪研究员团队合作,在《Signal Transduction and Targeted Therapy》期刊上发表了名为《Ambient light alleviates retinal neurodegeneration in mice by powering mitochondria via the engineered optoenergetic rhodopsin》的研究文章。研究表明,利用环境光为线粒体提供能量,能够显著缓解视网膜神经退行性疾病,尤其是青光眼。

该研究开发了一种工程化的光遗传学工具——线粒体靶向的光驱动质子泵视紫红质(PPR),即 mt-EcGAPR,通过环境光激活这一质子泵,能够有效供能线粒体,改善视网膜的退行性病变。
光遗传学与线粒体靶向治疗:开创性的新路径
光遗传学技术已成为一种革命性的手段,利用光信号精准调控细胞功能。由于线粒体膜电位在细胞生物能量学中的关键作用,研究者将光遗传学工具靶向线粒体,尝试通过调节质子梯度来修复线粒体功能障碍。这项技术在合成生物学和生物能量研究中取得了显著进展,尤其在非光合微生物中,光驱动质子泵已成功实现ATP合成。
然而,将光遗传学质子泵成功递送至哺乳动物体内的线粒体,尤其是在不破坏线粒体结构和功能的前提下,依然是一个巨大挑战。研究人员在这项最新研究中成功设计出了一种新的光敏质子泵——mt-EcGAPR,其具备了减少ROS生成和降低DNA损伤的能力。
创新治疗:mt-EcGAPR缓解青光眼小鼠模型的视网膜退行性病变
在青光眼小鼠模型中,研究团队通过环境光激活mt-EcGAPR,显著提高了ATP的合成,抑制了活性氧(ROS)的积累,进而有效保护了视网膜神经节细胞(RGC)免受退化损伤。通过这一机制,mt-EcGAPR 还能抑制内质网应激途径,进而保护视网膜的结构和功能。
此项治疗显著改善了青光眼小鼠的视力,证明了 mt-EcGAPR 作为一种新的治疗手段,在未来可能为多种由线粒体功能障碍引起的神经退行性疾病提供治疗思路。
前景展望:线粒体靶向治疗的潜力
这项研究为青光眼以及其他与线粒体功能障碍相关的神经退行性疾病治疗提供了新的希望。通过光遗传学和线粒体靶向质子泵的结合,研究人员成功地为细胞提供了能量,减缓了疾病进程,并改善了受损的细胞功能。
总的来说,mt-EcGAPR为治疗视网膜退行性疾病和其他线粒体功能障碍性疾病提供了一个前景广阔的方向。随着研究的深入和技术的成熟,这一创新治疗方案可能成为神经退行性疾病治疗的重要突破,为患者带来新的治疗选择。
结语
线粒体作为细胞能量代谢的核心,其健康状态直接关系到全身的生理功能。此次研究展示了mt-EcGAPR的巨大潜力,标志着在治疗神经退行性疾病和线粒体相关病理的道路上迈出了重要的一步。随着后续研究的推进,这项技术或将在更多临床疾病中得到应用,成为改善患者生活质量的重要治疗手段。