国产首个Bcl-2抑制剂!亚盛医药利沙托克拉获批上市,治疗复发性CLL/SLL
 搜医药
搜医药
关键词: #健康资讯
 搜医药
搜医药
关键词: #健康资讯
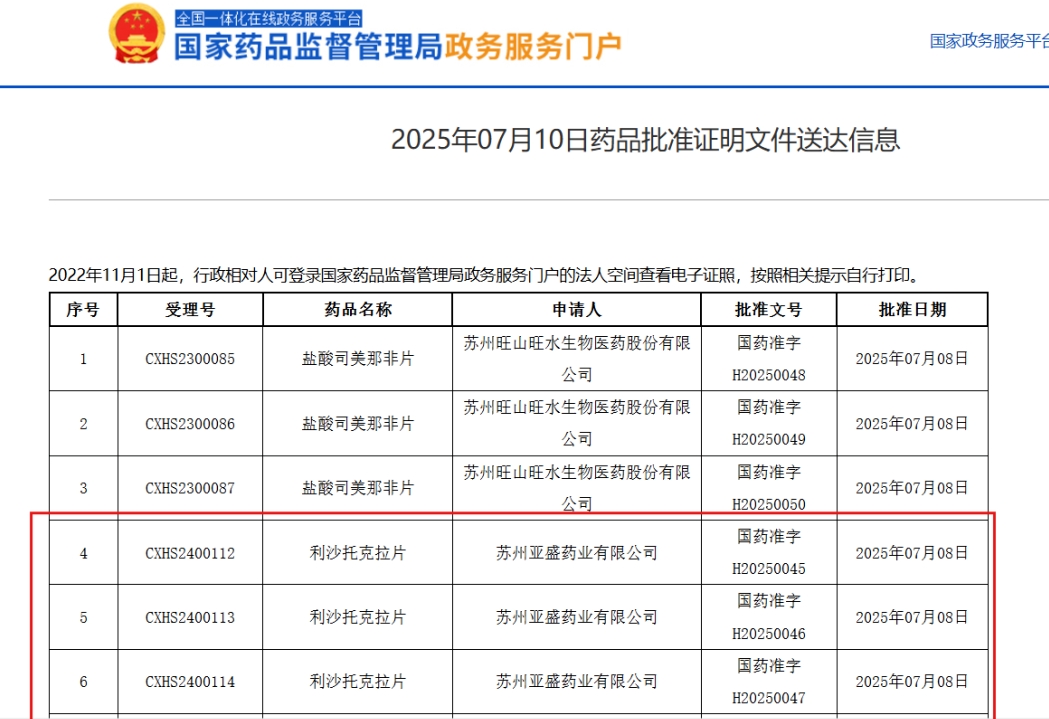
7月10日,国家药品监督管理局(NMPA)宣布,亚盛医药自主研发的利沙托克拉片(APG-2575)正式获批上市,用于治疗复发性或难治性(R/R)慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)。作为国产首个Bcl-2选择性抑制剂,利沙托克拉为国内肿瘤患者提供了新治疗选择,也标志着中国药企在难治性血液肿瘤领域迈出重要一步。
利沙托克拉:国产创新Bcl-2抑制剂的突破
利沙托克拉是亚盛医药通过自主研发推出的一款新型口服Bcl-2选择性抑制剂。该药物通过选择性阻断Bcl-2蛋白功能,恢复癌细胞的正常凋亡,从而治疗肿瘤。
独特机制与创新潜力:
Bcl-2蛋白是肿瘤细胞中抑制凋亡的重要因子,其过度表达是癌细胞逃避程序性死亡的关键机制。
利沙托克拉以高选择性和高活性靶向Bcl-2,通过调控线粒体凋亡通路,直接阻断肿瘤细胞生存路径,特别在CLL/SLL患者中显著有效。
全球领先地位:
利沙托克拉是全球第二款进入关键注册阶段并展现明确疗效的Bcl-2抑制剂,也是中国首个获批的国产药物。它不仅在CLL/SLL治疗中具备卓越的效果,还未来可在AML(急性髓系白血病)等多种血液肿瘤中释放潜力。
关键临床研究数据支持疗效与安全性
利沙托克拉此次获批基于中国开展的关键注册II期临床研究(APG2575CC201),评估了其单药用于R/R CLL/SLL患者的治疗效果与安全性。虽然研究结果尚未完全公布,但相关数据已在国际会议上提供了初步披露。
联合治疗的临床数据:
在第66届美国血液学会(ASH)年会上,亚盛医药展示了利沙托克拉联合阿可替尼或利妥昔单抗的最新疗效数据(NCT04215809)。
数据显示,在87例联合阿可替尼治疗患者中,总缓解率(ORR)达98%,中位缓解持续时间(DOR)与无进展生存期(PFS)均尚未达到成熟统计值,展现了显著治疗潜力。
维奈克拉耐药患者的疗效:
在接受维奈克拉后难治或不耐受的14名患者中,ORR为86%,12个月PFS为84%。在9名维奈克拉耐药患者中,ORR更高达89%,PFS长达18个月无疾病进展。
安全性数据:
各治疗队列的不良事件(TEAEs)发生率和严重程度相似,未发现无法耐受的严重副反应。
CLL/SLL概况与未满足的治疗需求
CLL/SLL是一种成熟B淋巴细胞克隆增殖性肿瘤,多发于老年人群。在欧美国家,CLL是成人最常见的白血病类型,全球每年新增病例超过10万例。
中国患者特点:
虽然中国的CLL/SLL发病率低于欧美,但近年来呈明显上升趋势,且患者发病年龄偏低、侵袭度较高,增加了治疗难度。
SLL与CLL是同一种疾病的不同临床表现形式,且约20%的SLL患者最终会进展为CLL。
现有治疗的局限性:
虽然免疫化疗以及BTKi(布鲁顿酪氨酸激酶抑制剂)显著提高初治缓解率,但R/R患者预后仍然不佳,亟需更安全、有效的新疗法。
Bcl-2靶向治疗:破局难治性血液肿瘤的重要方向
Bcl-2蛋白通过抑制线粒体细胞色素C释放和调控凋亡激活因子,发挥抗凋亡作用。其在多种恶性血液肿瘤中均超高水平表达,是细胞逃避死亡的重要机制。
全球成药性挑战:
Bcl-2靶点的药物研发历时近40年,成药性极具挑战。
至今全球仅有艾伯维的维奈克拉获批上市,后续抢占市场的药物如百济的索托克拉仍处审评阶段。
利沙托克拉的价值:
利沙托克拉此次获批填补了中国在Bcl-2靶点药物领域的空白,为R/R CLL/SLL患者提供了新选择。
凭借显著疗效与良好安全性,有望成为中国自主药物创新发展的代表性成果。
未来展望:全球扩展与多适应症布局
目前,利沙托克拉正推进4项全球注册III期临床试验,适应症涵盖CLL/SLL、急性髓系白血病(AML)、骨髓增生异常综合征(MDS)等。值得关注的是,其中一项试验已获美国FDA许可。
多适应症布局:
利沙托克拉在更多恶性肿瘤中展示出的单药及联合治疗潜力,将进一步扩展其市场空间。
全球化路径:
亚盛医药依托国内外临床证明,将推动利沙托克拉迈向全球血液肿瘤领域,为更多患者带来福音。
结语:国产创新引领血液肿瘤治疗新格局
亚盛医药利沙托克拉片的获批,不仅实现了国产Bcl-2抑制剂的零突破,也为难治性CLL/SLL患者提供了全新治疗解决方案。作为一款具有广阔前景的标志性药物,利沙托克拉未来将在改善患者预后与提升生活质量方面发挥重要作用,并成为中国药企走向国际的重要里程碑。
2025-12-27

2025-12-27

2025-12-27

2025-12-27

2025-12-27