血管性痴呆治疗现曙光,炎症“刹车”助力脑组织修复
 搜医药
搜医药
关键词: #健康资讯
 搜医药
搜医药
关键词: #健康资讯
随着全球老龄化进程加速,痴呆症已成为重大公共健康问题。目前全球约有5000万人罹患痴呆症,预计到2050年这一数字将增至1.52亿。其中,血管性痴呆(VaD),作为仅次于阿尔茨海默病的第二大类型,占所有痴呆病例的10%-20%,并常与阿尔茨海默病共存。然而,相比阿尔茨海默病,血管性痴呆的研究和治疗进展较为滞后,目前尚无有效药物能促进患者康复。
近日,《Cell》期刊发表了一篇题为《Deconstructing the Intercellular Interactome in Vascular Dementia with Focal Ischemia for Therapeutic Applications》的研究文章。该研究由美国加州大学洛杉矶分校等机构的科学家完成,揭示了血管性痴呆关键的脑修复机制,发现了一种可能用于治疗的新型信号通路。这一发现为血管性痴呆患者提供全新的希望。
研究背景:血管性痴呆的核心难点
血管性痴呆的核心病理特征是脑部局部缺血引发的炎症反应,导致受损区域随时间不断扩大,从而加重症状。目前的挑战在于,血管性痴呆并非单一病理原因所导致,而是多因素协同作用的结果,包括血管健康状况、炎症反应及衰老相关机制等。
痴呆进程中,大脑受损区域会逐渐扩散,传统疗法仅能减缓症状,但无法从根本上修复损伤区域。目前对于血管性痴呆的治疗多集中于支持性护理,而缺乏针对性的药物治疗。
研究亮点:识别关键信号通路,发现新型治疗靶点
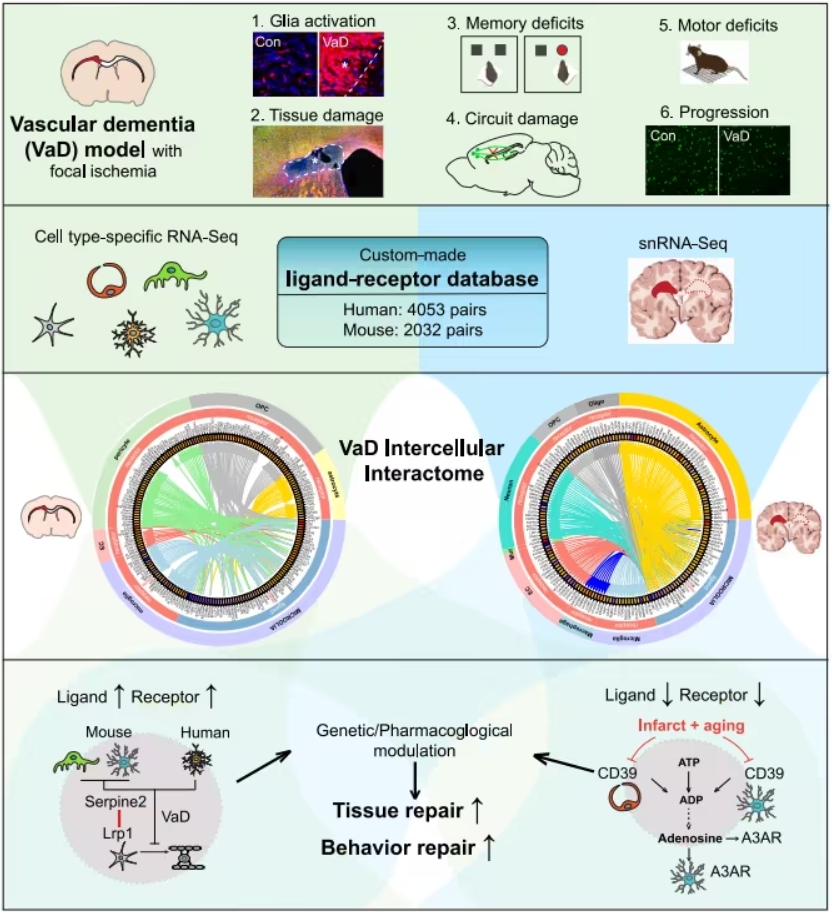
研究团队通过血管性痴呆小鼠模型,并结合人类单细胞RNA测序(snRNA-seq)数据进行多层次分析,揭示了血管性痴呆中涉及的关键细胞信号通路。
核心发现:
Serpine2和Lrp1信号通路
研究发现,Serpine2(一种调控分子的表达减少)对少突胶质细胞祖细胞(OPC)的修复分化起到关键作用。Serpine2的减少有助于激活OPC修复功能从而促进脑组织再生。
CD39-A3AR信号通路
CD39和腺苷A3受体(A3AR)是血管细胞与脑中炎症细胞(小胶质细胞)之间的重要交互信号。当这种信号通路受到干扰时,会加重炎症反应。通过重新激活这一通路,能够有效降低炎症对脑组织的损害。
研究团队结合实验室动物与人类数据,首次明确了CD39-A3AR通路对血管性痴呆大脑修复的关键意义,并借助一种用于银屑病治疗的A3AR特异性激动剂,在血管性痴呆小鼠模型中进行测试,发现其能够恢复脑组织完整性并显著改善记忆和行为功能。
治疗优势:靶向作用实现延迟干预的有效性
一个重要发现是,该疗法在疾病进展阶段依然有效。通过靶向CD39-A3AR通路,这种治疗不仅能抑制炎症,也能逆转脑损伤。研究显示,这种激动剂即使在疾病确诊较晚阶段给予,也能显著促进记忆恢复及步态改善。这一特点对于通常确诊较晚的血管性痴呆患者尤其重要。
研究人员强调,这种治疗方法能够解决炎症引起的损伤机制,进而逆转病理改变,而并非只是暂时缓解症状。这为血管性痴呆治疗带来了全新的视角和策略。
未来方向:从动物模型到人类临床试验
尽管这一研究结果令人振奋,但距离广泛临床应用仍有一定距离。目前的研究是基于开放标签的小鼠模型和人类相关数据分析,尚需更大规模的随机对照临床试验进行验证。
未来研究重点将包括:
优化治疗剂量: 通过更精确的剂量实验确保药物安全性与疗效;
生物标志物探索: 开发精准检测工具以实时监控治疗效果;
长期疗效观察: 验证治疗的长期安全性及对患者生活质量的全面影响。
意义与展望:炎症“刹车”为血管性痴呆治疗带来曙光
在这项突破性研究中,研究者成功揭示了血管性痴呆进程中,脑细胞间通讯失调对疾病发展的关键作用,并通过重新激活关键信号通路,展示了靶向炎症反应的治疗潜力。
这项研究不仅为血管性痴呆患者提供了一个全新的治疗靶点,还为其他衰老相关的神经退行性疾病(如阿尔茨海默病)提供了重要启示。如果能够顺利从实验室迈向临床应用,血管性痴呆将可能迎来首个有效的药物治疗。
随着研究的进一步推进,这一疗法有望显著改善血管性痴呆患者的预后,并减轻全球老龄化背景下带来的沉重健康负担。研究者期待,通过这一新治疗策略,为数以百万计的患者及其家庭带来希望和福音。
2025-12-27

2025-12-27

2025-12-27

2025-12-27

2025-12-27