德曲妥珠单抗(T-DXd)新适应症申报获受理:联合帕妥珠单抗用于HER2阳性乳腺癌一线治疗
 搜医药
搜医药
关键词: #健康资讯
 搜医药
搜医药
关键词: #健康资讯
2025年11月5日,国家药品监督管理局药品审评中心(CDE)官网显示,第一三共公司研发的注射用德曲妥珠单抗(DS-8201a,商品名T-DXd,规格100mg/瓶)的新适应症上市申请已正式获受理。
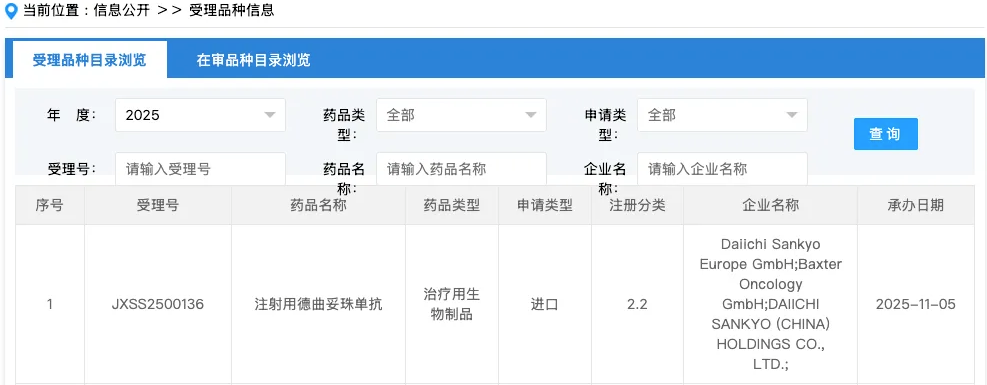
该申请的适应症为:联合帕妥珠单抗,用于治疗不可切除或转移性HER2阳性成人乳腺癌患者的一线治疗。这意味着T-DXd有望进一步拓展其在乳腺癌领域的临床应用,为更多患者带来治疗新选择。
多次申报,拓展HER2靶向治疗版图
自2023年2月在中国首次获批以来,德曲妥珠单抗已逐步成为HER2阳性肿瘤治疗的重要创新药物。此次新适应症申请,是其在中国递交的第八个适应症申请,同时也是第五个针对乳腺癌适应症的上市申请。
这一连串的拓展动作,反映出该药物在HER2靶向治疗领域的持续临床潜力,也显示出第一三共在肿瘤精准治疗方面的战略布局不断深化。
研究依据:DESTINY-Breast09(DB-09)试验结果
此次申报的核心数据来源于全球多中心III期临床研究DESTINY-Breast09(DB-09)的中期分析结果。
该研究主要评估T-DXd单药或联合帕妥珠单抗与标准一线疗法(SoC THP方案,即紫杉烷+曲妥珠单抗+帕妥珠单抗)在HER2阳性、晚期或转移性乳腺癌患者中的疗效与安全性。
试验采用随机、三组、设盲设计,主要终点为由独立盲态影像评估委员会(BICR)评估的无进展生存期(PFS),关键次要终点为总生存期(OS)。目前公布的中期结果显示,T-DXd联合方案在疗效方面表现出显著优势。
德曲妥珠单抗:引领HER2靶向治疗新方向
作为一款创新的抗体偶联药物(ADC),德曲妥珠单抗通过将曲妥珠单抗的靶向能力与高效细胞毒药物递送机制相结合,在多个HER2相关癌种中展现出突破性疗效。
此次联合帕妥珠单抗的一线治疗方案,若能最终获批,将为HER2阳性晚期乳腺癌患者提供更具疗效潜力、毒性更低的新治疗路径,也为临床医生在治疗策略上带来更丰富的选择空间。
结语:HER2治疗领域再迎新机遇
随着DESTINY-Breast系列研究的深入推进,T-DXd的适应症版图正在迅速扩大。此次新适应症的受理不仅体现了中国监管机构对创新药物临床价值的认可,也预示着HER2阳性乳腺癌的治疗格局或将迎来新一轮升级。
未来,随着更多研究数据的公布,T-DXd有望继续在全球乳腺癌及其他HER2阳性实体瘤的治疗中发挥核心作用,为患者带来更长远的生存获益。
2025-12-27
2025-12-27

2025-12-27

2025-12-27

2025-12-27