百济神州与安进合作的塔拉妥单抗在中国获受理,或为小细胞肺癌治疗带来新希望
 搜医药
搜医药
关键词: #健康资讯
 搜医药
搜医药
关键词: #健康资讯
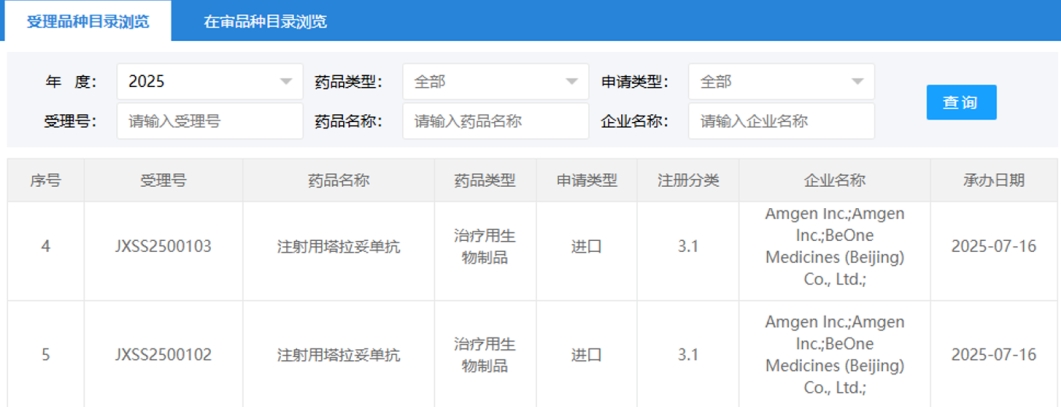
2025年7月16日,国家药品监督管理局(NMPA)官网发布消息,百济神州与安进联合开发的创新药物 塔拉妥单抗(Tarlatamab) 已通过药品上市申请审评,获得正式受理。这款药物被纳入了优先审评程序,旨在治疗广泛期小细胞肺癌(ES-SCLC)的成人患者,特别是那些曾接受过至少二线治疗并未获得显著效果的患者。
通过CD3/DLL3双特异性作用机制,塔拉妥单抗带来新的治疗方案
塔拉妥单抗是全球首个针对 DLL3 和 CD3 的双特异性抗体(BiTE),由安进公司研发。该药物能够同时结合肿瘤细胞表面的 DLL3 蛋白和T细胞表面的 CD3 蛋白,从而激活T细胞并诱导肿瘤细胞裂解。值得一提的是,约 85%-96% 的小细胞肺癌患者肿瘤细胞表面表达 DLL3,而正常细胞几乎不表达这一蛋白,使得 DLL3 成为一个理想的治疗靶点。
取得全球首个批准,塔拉妥单抗为SCLC带来突破
2024年5月,基于 DeLLphi-301 全球II期临床研究的成果,塔拉妥单抗获得了美国FDA的加速审批,成为全球首个获批的 DLL3/CD3双特异性抗体。这一药物被批准用于治疗那些 含铂化疗 失败的 ES-SCLC 患者。临床数据显示,塔拉妥单抗的客观缓解率(ORR)高达 40%,治疗后患者的中位缓解持续时间(DoR)为 9.7个月,且中位总生存期(mOS)达到14.3个月,展现出卓越的治疗效果。
全球三期临床试验DeLLphi-304的积极结果
此外,塔拉妥单抗的全球III期临床试验,即 DeLLphi-304 研究的中期分析结果也引起了广泛关注。该研究针对 一线含铂化疗 失败的SCLC患者进行,研究结果表明,塔拉妥单抗治疗的中位总生存期为 13.6个月,相比标准化疗的 8.3个月,延长了 5.3个月,且死亡风险降低了40%(HR=0.60;P<0.001)。此外,治疗组的3级以上不良反应发生率显著低于化疗组(27% 对比 62%),证明塔拉妥单抗的安全性和耐受性优于传统化疗。
未来研发计划:拓展适应症和临床试验
百济神州与安进达成的全球战略合作协议,旨在共同推进塔拉妥单抗在中国的开发与商业化。两家公司计划在中国进行一项名为 DeLLphi-307 的III期临床研究,主要针对 三线及后线 患者的治疗。除了目前的临床试验外,百济神州和安进还在开展其他多项临床研究,旨在拓展塔拉妥单抗的治疗适应症,并推进其上市进程。
SCLC治疗面临挑战,塔拉妥单抗或为突破
小细胞肺癌(SCLC) 是一种高度侵袭性且恶性程度极高的肺癌,约占全球所有肺癌病例的 15%。其中,约有 70% 的SCLC患者被诊断为 广泛期(ES-SCLC)。目前SCLC的标准治疗主要依赖于 含铂化疗,但大多数患者在接受治疗后 6个月内 会出现疾病复发,且 复发后的治疗选择非常有限,因此,SCLC患者的中位生存期仅为 8-10个月。在这种情况下,塔拉妥单抗为SCLC患者带来了新的希望。
结语:期待塔拉妥单抗的中国上市与更广泛应用
塔拉妥单抗在中国的上市申请获得受理,标志着其在SCLC治疗领域的重要进展。随着更多临床研究的推进,塔拉妥单抗或将在未来成为SCLC治疗中的一线选择,为患者带来切实的临床获益。百济神州与安进的合作无疑为 肿瘤免疫治疗 打开了新的大门,尤其是在 小细胞肺癌 这一挑战性疾病的治疗中,塔拉妥单抗可能会成为治疗方案的关键突破。
2025-12-27

2025-12-27

2025-12-27

2025-12-27

2025-12-27