


那昔妥单抗
 海外直邮
海外直邮
 药师指导
药师指导
 隐私服务
隐私服务
 签订合同
签订合同
温馨提示: 药品图片来自网络,仅供参考;如遇新包装上市可能存在上新滞后,请以实物为准,如有侵权,请联系删除。
适用于患有神经母细胞瘤的儿童和成人患者
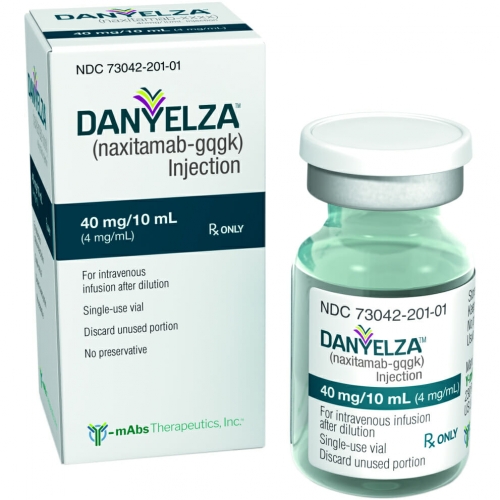
药品名:Danyelza
英文名:naxitamab-gqgk injection
中文名:那昔妥单抗
全部名称:Danyelza、naxitamab-gqgk injection、那昔妥单抗
药品简述
Naxitamab-gqgk 是一种糖脂二唾液酸神经节苷脂 (GD2) 结合重组人源化单克隆 IgG1 抗体,含有人框架区和鼠互补决定区。纳昔单抗-gqgk在中国仓鼠卵巢细胞系中产生,分子量约为144 kDa,未发生糖基化。
DANYZELA(naxitamab-gqgk) 注射液是一种无菌、不含防腐剂、澄清至略带乳光、无色至淡黄色的静脉输注溶液。每个单剂量小瓶含 40 mg naxitamab-gqgk 的 10 mL 溶液。每毫升溶液含4 mg naxitamab-gqgk、无水柠檬酸 (0.71 mg)、泊洛沙姆188(1.5 mg)、氯化钠 (7.01 mg)、柠檬酸钠 (6.3 mg) 和注射用水 (USP)。pH值约为5.7。
适应症和用途
本品适用于与粒细胞-巨噬细胞集落刺激因子 (GM-CSF) 联合治疗已证实对既往治疗有部分缓解、轻微缓解或疾病稳定的1岁及以上儿童患者和成人复发性或难治性骨或骨髓高危神经母细胞瘤患者。
基于总缓解率和缓解持续时间,该适应症获得加速批准。该适应症的继续批准可能取决于验证性试验中临床获益的验证和描述。
剂型和规格
注射液:40 mg/10 mL(4 mg/mL),澄清至略带乳光,无色至浅黄色溶液,装于单剂量小瓶中。
用法用量
一、推荐剂量
本品的推荐剂量为 3 mg/kg/天(最高 150 mg/天),在每个治疗周期的第1、3和5天给药,稀释后静脉输注给药 [参见用法用量],与 GM-CSF 联合皮下给药,如表1所示。有关推荐剂量信息,请参阅 GM-CSF 处方信息。
每4周重复治疗周期,直至完全缓解或部分缓解,然后每4周再重复5个周期。后续周期可每8周重复一次。如果发生疾病进展或不可接受的毒性,应停用本品和GM-CSF。
遗漏剂量
如果漏服一剂本品,应在下一周第10天前补服。在输注本品的第一天以及第二次和第三次输注的前一天和当天分别给予GM-CSF 500 µg/m 2/天(即500 µg/m 2/天共5天)。
二、前驱用药和支持性用药
输注前和输注期间的疼痛管理 [见警告和注意事项]:
1、在每个周期首次输注本品前5天,开始为期12天的神经性疼痛预防性用药疗程(第-4天至第7天),如加巴喷丁。
2、每次开始输注本品前 45-60 min 口服阿片类药物,并在输注期间根据需要额外静脉给予阿片类药物治疗爆发性疼痛。
3、对于阿片类药物不能充分控制的疼痛,考虑使用氯胺酮。
前驱用药:降低输液相关反应和恶心/呕吐的风险 [参见警告和注意事项和不良反应]。
1、在首次输注本品前 30 min 至2小时内静脉输注皮质类固醇(如甲泼尼龙2 mg/kg,最大剂量为 80 mg 或等效皮质类固醇剂量)。如果前一次输注或前一个周期发生重度输注反应,在后续输注时给予皮质类固醇前驱用药。
2、每次输注前 30 min 给予抗组胺药、H2拮抗剂、对乙酰氨基酚和止吐药。
针对不良反应的剂量调整
针对不良反应的本品推荐剂量调整见表2。
三、给药
1、根据建议,以稀释的静脉输注方式给予本品。请勿静脉推注或推注本品 [见用法用量]。
2、首次输注(第1周期第1天)时,应在 60 min 内静脉输注本品。
后续输注时,应根据耐受情况在 30-60 min 内静脉输注本品。[参见用法用量]。
3、每次输注后观察患者至少2小时。
警告和注意事项
1、严重输液相关反应
本品可引起需要紧急干预的严重输液反应,包括液体复苏、支气管扩张剂和皮质类固醇给药、入住重症监护室、降低输注速率或中断本品输注。输液反应包括低血压、支气管痉挛、缺氧和喘鸣。
研究201中4%的患者和研究12-230中18%的患者发生严重输注相关反应。研究201中100%的患者和研究12-中94%的患者发生任何级别的输液相关反应
230.研究201中100%的患者和研究12-230中89%的患者发生任何级别的低血压。
在研究201中,68%的患者发生3级或4级输液反应;在研究12-230中,32%的患者发生3级或4级输液反应。在研究201中,12%的患者发生过敏反应,2例患者 (8%) 因过敏反应而永久停用本品。研究12-230中的1例患者 (1.4%) 在完成本品输注后1.5小时发生4级心脏停搏。
在研究201中,输注反应通常发生在完成本品输注后24小时内,最常发生在开始输注后 30 min 内。输注反应在每个周期首次输注本品期间最常见。80%的患者需要降低输注速率,80%的患者因至少1例输注相关反应而中断输注。
根据建议,预先给予抗组胺药、对乙酰氨基酚、H2拮抗剂和皮质类固醇。在心肺复苏药物和设备可用的情况下,在每次输注本品期间和完成后至少2小时内,密切监测患者是否出现输液反应的体征和症状。
根据严重程度降低输注速率、中断输注或永久停用本品,并根据需要进行适当的医疗管理 [参见用法用量和禁忌症]。
2、神经毒性
本品可引起重度神经毒性,包括重度神经性疼痛、横贯性脊髓炎和可逆性后部白质脑病综合征。
2.1疼痛
研究201中100%的患者和研究12-230中94%的患者发生疼痛,包括腹痛、骨痛、颈痛和四肢痛。研究201中72%的患者发生3级疼痛。研究201中1例患者 (4%) 因疼痛需要中断输注。疼痛通常在输注本品期间开始出现,在研究201中的中位持续时间不到1天(范围:不到1天,最长62天)[参见不良反应]。
术前使用治疗神经性疼痛的药物(如加巴喷丁)和口服阿片类药物。根据需要静脉给予阿片类药物治疗爆发性疼痛 [见用法用量]。根据严重程度永久停用本品 [参见用法用量]。
2.2横贯性脊髓炎
DANYELZA 曾发生横贯性脊髓炎。发生横贯性脊髓炎的患者应永久停用本品 [参见用法用量]。
2.3可逆性后部白质脑病综合征 (RPLS)
研究12-230中有2例 (2.8%) 患者发生可逆性后部白质脑病综合征 (RPLS)(也称为可逆性后部脑病综合征或PRES)。事件发生于首个周期本品治疗完成后2天和7天。在本品输注期间和输注后监测血压,并评估神经系统症状 [参见警告和注意事项]。如果发生症状性RPLS,应永久停用本品 [参见用法用量和不良反应]。
2.4周围神经病变
研究201中32%的患者和研究12-230中25%的患者发生周围神经病变,包括周围感觉神经病变、周围运动神经病变、感觉异常和神经痛。大多数神经病的体征和症状开始于输注当天,研究201中神经病的中位持续时间为5.5天(范围:0-22天),研究12-230中为0天(范围:0-22天)[见不良反应]。
根据严重程度永久停用本品 [见用法用量 (2.3)]。眼部神经系统疾病
眼部神经系统疾病,包括瞳孔不等、视物模糊、调节障碍、瞳孔散大、视觉
研究201中24%的患者和研究12-230中19%的患者发生损害和畏光。在研究201中,眼部神经系统疾病的中位持续时间为17天(范围:0-84天),2例患者 (8%) 发生的事件在数据截止时尚未消退,在研究12-230中,中位持续时间为1天(范围:小于1天-21天)。根据严重程度永久停用本品 [参见用法用量和不良反应]。
2.5尿潴留时间延长
研究201和研究12-230中分别有1例 (4%) 和3例 (4%) 患者发生尿潴留。两项研究中的所有事件均发生在输注本品当天,并持续0-24天。对于阿片类药物停药后仍未消退的尿潴留患者,应永久停用本品 [参见用法用量和不良反应]。
3、高血压
研究201中44%的患者和研究12-230中28%的接受本品治疗的患者发生高血压。研究201中4%的患者和研究12-中7%的患者发生3级或4级高血压
230.研究12-230中的4例患者 (6%) 因高血压而永久停用本品。在两项研究中,大多数事件发生在本品输注当天,且发生在本品输注后9天内。
未控制的高血压患者不得开始本品治疗。在输注本品期间以及每个周期第1-8天至少每天监测一次血压,并评估高血压并发症,包括 RPLS [参见警告和注意事项]。根据严重程度中断本品输注并以降低后的速率恢复输注,或永久停用本品 [参见用法用量和不良反应]。
4、胚胎-胎仔毒性
根据其作用机制,孕妇使用本品可能会对胎儿造成伤害。告知有生育能力的女性(包括妊娠女性)对胎儿的潜在风险。建议有生育能力的女性在接受本品治疗期间及末次给药后2个月内采取有效的避孕措施。[参见特殊人群用药]。
不良反应
1、临床试验经验
由于临床试验是在各种不同的条件下进行的,因此在一种药物的临床试验中观察到的不良反应发生率不能直接与另一种药物的临床试验中的发生率进行比较,也不能反映在实践中观察到的发生率。
在两项开放性、单组研究(研究201(n = 25) 和研究12-230(n = 72))中,在经初始或后续治疗后证实部分缓解、轻微缓解或疾病稳定的难治性或复发性高危骨或骨髓神经母细胞瘤患者以及处于第二次完全缓解的患者中评价了本品联合 GM-CSF 的安全性。接受本品治疗的患者
9mg/kg/周期,在每个周期的第1周3次单独静脉输注3 mg/kg(第1、3和5天)。患者还在第-4天至第0天接受GM-CSF 250 µg/m 2/天皮下给药和 GM-CSF
500 µg/m 2/天皮下给药,第1-5天 [参见临床研究]。
研究201和12-230中最常见的不良反应(任一研究中≥25%)为输液反应、疼痛、心动过速、呕吐、咳嗽、恶心、腹泻、食欲下降、高血压、疲乏、多形性红斑、周围神经病变、荨麻疹、发热、头痛、注射部位反应、水肿、焦虑、局部水肿和易激惹。最常见的3级或4级实验室检查异常(任何一项研究中≥5%)为淋巴细胞减少、中性粒细胞减少、血红蛋白减少、血小板计数减少、钾减少、丙氨酸氨基转移酶升高、葡萄糖减少、钙减少、白蛋白减少、钠减少和磷酸盐减少。
2、免疫原性
与所有治疗性蛋白一样,本品可能具有免疫原性。抗药抗体形成的检测高度依赖于试验的灵敏度和特异性。此外,试验中观察到的抗药抗体(包括中和抗体)阳性发生率可能受多种因素影响,包括试验方法、样本处理、样本采集时间、合并用药和基础疾病。由于这些原因,将下述研究中的抗药抗体发生率与其他研究或其他 naxitamab 产品中的抗药抗体发生率进行比较可能会产生误导。
在研究201中,24例接受本品治疗的患者中有2例 (8%) 的抗药抗体 (ADA) 检测结果呈阳性。
在研究12-230中,117例患者中的27例 (23%) 在接受本品治疗后通过未经充分验证的方法检测到 ADA 阳性;因此,ADA的发生率可能不可靠。
3、上市后经验/自发报告
从 DANYELZA 扩大使用报告中发现了以下不良反应。由于这些反应是由规模不确定的人群自愿报告的,因此不可能始终可靠地估计其频率或确定其与药物暴露的因果关系。
神经系统:横贯性脊髓炎
禁忌
本品禁用于对 naxitamab-gqgk 有重度超敏反应史的患者。反应包括速发过敏反应 [参见警告和注意事项]。
特殊人群
1、妊娠
风险总结
根据其作用机制,孕妇使用本品可能会对胎儿造成伤害 [参见临床药理学 (12.1)]。尚无妊娠女性使用本品的可用数据,尚未进行本品的动物生殖研究。随着妊娠进展,IgG1单克隆抗体以线性方式通过胎盘转运,在妊娠晚期转移的量最大。告知妊娠女性对胎儿的潜在风险。
在美国一般人群中,临床确认的妊娠中重大出生缺陷和流产的估计背景风险分别为2%-4%和15%-20%。
2、哺乳期
风险总结
尚无关于人乳汁中是否存在 naxitamab-gqgk 或其对母乳喂养婴儿或乳汁生成影响的数据,但人乳汁中存在人IgG。由于母乳喂养的婴儿可能会发生 DANYELZA 的严重不良反应,建议女性在治疗期间和 DANYELZA 末次给药后2个月内不要哺乳。
3、有生育能力的女性和男性
孕妇使用本品可能会对胎儿造成伤害 [参见特殊人群用药 (8.1)]。
3.1妊娠试验
开始本品治疗前,确认有生育能力的女性的妊娠状态。
3.2避孕
雌性
建议有生育能力的女性在接受本品治疗期间及末次给药后2个月内采取有效的避孕措施。
4、儿童用药
已在1岁及以上儿童患者中确定了本品联合 GM-CSF 治疗复发性或难治性高危骨或骨髓神经母细胞瘤的安全性和有效性,这些患者在既往治疗后显示部分缓解、轻微缓解或疾病稳定。
尚未确定在1岁以下儿童患者中的安全性和有效性。
5、老年患者用药
神经母细胞瘤在很大程度上是儿童和年轻成人患者的疾病。DANYELZA联合 GM-CSF 的临床研究未纳入65岁及以上的患者。
作用机制
Naxitamab-gqgk 与糖脂 GD2 结合。GD2是一种双唾液酸神经节苷脂,在神经母细胞瘤细胞和其他神经外胚层来源的细胞上过表达,包括中枢神经系统和周围神经。在体外,naxitamab-gqgk能够与细胞表面 GD2 结合,并诱导补体依赖性细胞毒性 (CDC) 和抗体依赖性细胞介导的细胞毒性 (ADCC)。
储存和处理
DANYZELA(naxitamab-gqgk) 注射液是一种无菌、不含防腐剂、澄清至略带乳光、无色至浅黄色的静脉输注溶液,以纸箱形式提供,内含1个 40 mg/10 mL(4 mg/mL) 单剂量小瓶。
使用前,将 DANYELZA 小瓶置于外包装盒中,在2℃-8℃ (36℉-46℉) 下避光冷藏储存。
生产厂家
Y-mAbs Therapeutics.美国
-
问那昔妥单抗(Naxitamab)Danyelza适应症和治疗效果怎么样答那昔妥单抗(Naxitamab)Danyelza适应症和治疗效果怎么样,Naxitamab(Naxitamab)是一款针对神经节苷脂GD2的人源化单克隆抗体。在临床试验中,它已显示出对神经母细胞瘤患者的疗效。具体来说,那昔妥单抗通过与肿瘤细胞表面的GD2结合,能够引起抗体介导的细胞毒性反应并激活补体系统,从而达到杀伤肿瘤的效果。在某些临床试验中,那昔妥单抗已显示出对神经母细胞瘤患者的疗效,包括诱导肿瘤细胞发生死亡和抑制肿瘤生长等。那昔妥单抗(Naxitamab),商品名Danyelza,是一种针对神经母细胞瘤(neuroblastoma)的单克隆抗体疗法。近年来,它被批准用于复发性或难治性骨或骨髓高危神经母细胞瘤患者的治疗。本文将对其适应症和治疗效果进行详细探讨。 1. 适应症简介 那昔妥单抗主要用于治疗复发性或难治性骨或骨髓高危神经母细胞瘤。这种癌症多见于儿童,通常表现为在神经系统内异常增生的肿瘤。复发或难治的病例治疗难度大,治疗选择有限,因此Danyelza的出现为这类患者带来了新的希望。 2. 治疗机制 那昔妥单抗的治疗机制主要是通过靶向神经母细胞瘤细胞表面的抗原,为免疫系统提供识别和攻击肿瘤细胞的机会。该药物通过结合到神经母细胞瘤细胞表面的DMAG抗原,诱导抗体依赖的细胞介导细胞毒性(ADCC),从而有效消灭肿瘤细胞。 3. 临床试验结果 临床研究显示,那昔妥单抗在治疗复发或难治性骨或骨髓高危神经母细胞瘤患者中具有显著的疗效。在一项关键的临床试验中,使用Danyelza的患者相较于传统疗法展现出更高的总体反应率和更长的无进展生存期。这些结果表明Danyelza作为一种新的治疗选择具有重要临床意义。 4. 不良反应与耐受性 虽然那昔妥单抗在疗效上表现出色,但仍需关注其不良反应。常见的不良反应包括发热、恶心及输注相关反应等,这些反应大多数为可控状态。此外,医生会在治疗过程中密切监测患者的耐受性,以确保安全性和有效性。 综上所述,那昔妥单抗(Danyelza)为复发性或难治性骨或骨髓高危神经母细胞瘤患者提供了一种新的治疗选择。其独特的靶向机制结合临床试验中显示的积极效果,预示着在未来的临床应用中,Danyelza可能会改善患者的预后。临床医生和研究人员将继续探索其在更广泛患者群体中的应用潜力。 [ 详情 ]已帮助1384人2025-11-20 15:20:19
-
问那昔妥单抗(Naxitamab)Danyelza仿制药如何代购答那昔妥单抗(Naxitamab)Danyelza仿制药如何代购,那昔妥单抗(Naxitamab)的参考价为135911元左右。那昔妥单抗(Naxitamab)是一种用于治疗复发性或难治性骨或骨髓高危神经母细胞瘤的新型单克隆抗体药物,商品名为Danyelza。由于其昂贵且在一些地区难以获得,很多患者和家属选择通过代购的方式获取此药物。本文将讨论关于那昔妥单抗的基本信息、代购的途径及注意事项。 1. 那昔妥单抗的基本信息 那昔妥单抗是一种针对神经母细胞瘤细胞表面特定抗原的单克隆抗体,主要用于治疗复发性或难治性患者。该药物通过靶向特定癌细胞,有效帮助患者减缓病情进展,提高生存率。Danyelza通常与其他治疗方式联合使用,以提升疗效。 2. 代购的途径 为了获取那昔妥单抗,患者通常会选择代购。代购途径主要包括通过跨境电商平台、海外药房以及熟悉医药行业的个人网络等。在选择代购渠道时,需确保其合法合规,避免购买到假药或劣质药物。 3. 选择可靠的代购方 在进行代购时,选择一个值得信赖的代购方至关重要。建议患者及其家属与有经验的患者群体或医生进行沟通,询问可靠的代购渠道。同时,应注意查看代购方的资质和声誉,尽量选择有良好口碑和真实评价的代购商。 4. 代购时的注意事项 代购那昔妥单抗时,还应关注药品的保存和运输条件。该药物通常需要冷藏保存,确保在运输过程中不会受到温度影响。此外,务必确认药品的有效期和包装完好性,避免因运输不当而影响药效。 综上所述,那昔妥单抗(Naxitamab)作为治疗神经母细胞瘤的一种新型药物,虽然面临着高昂的价格和获取难度,但通过正确的代购渠道,患者仍然有机会获得这种重要的治疗药物。在代购过程中,一定要保持警惕,选择合法、可靠的途径,确保自己能安全、有效地使用所需药物。 [ 详情 ]已帮助1040人2025-11-03 08:06:02
-
问那昔妥单抗(Naxitamab)Danyelza的药物相互作用是什么答那昔妥单抗(Naxitamab)Danyelza的药物相互作用是什么,Naxitamab(Naxitamab)是一款针对神经节苷脂GD2的人源化单克隆抗体。在临床试验中,它已显示出对神经母细胞瘤患者的疗效。具体来说,那昔妥单抗通过与肿瘤细胞表面的GD2结合,能够引起抗体介导的细胞毒性反应并激活补体系统,从而达到杀伤肿瘤的效果。在某些临床试验中,那昔妥单抗已显示出对神经母细胞瘤患者的疗效,包括诱导肿瘤细胞发生死亡和抑制肿瘤生长等。那昔妥单抗(Naxitamab)Danyelza是一种用于治疗复发性或难治性骨或骨髓高危神经母细胞瘤的单克隆抗体药物。随着其在临床应用中的推广,了解其药物相互作用变得尤为重要。本文将探讨那昔妥单抗Danyelza的药物相互作用及其在治疗中的影响。 1. 那昔妥单抗概述 那昔妥单抗是一种针对神经母细胞瘤细胞表面特定抗原的单克隆抗体。这种药物通过增强免疫系统对肿瘤细胞的攻击机制来发挥作用,通常用于治疗儿童的高危神经母细胞瘤。荟萃分析显示,Danyelza在临床上能够提高生存率,尤其是对于复发或难治性病例。 2. 药物相互作用的机制 药物相互作用通常通过多种机制发生,这些机制可能涉及药物代谢酶的抑制或诱导、药物与蛋白结合的竞争、以及药物在体内药效变化等方面。那昔妥单抗可能会与其他药物共同作用,导致其疗效增强或减弱。因此,药物之间的相互作用需要特别关注,以确保患者的安全和治疗效果。 3. 常见药物相互作用 根据目前的研究,那昔妥单抗与某些药物可能会产生相互作用。例如,部分化疗药物可能会增强Danyelza的毒性,特别是在免疫系统受到抑制的患者中。此外,某些抗生素和抗病毒药物也可能对其疗效增减产生影响。因此,在治疗过程中,需要密切监测患者用药情况,及时调整方案。 4. 临床监测与管理 在使用那昔妥单抗的过程中,医生需对患者的用药历史进行全面评估,以识别潜在的药物相互作用风险。此外,建议进行定期的血液检查和其他相关检测,以确保患者的药物浓度在安全范围内,并及时发现可能的不良反应。良好的沟通也能帮助患者了解药物的使用及其可能的相互作用。 综上所述,那昔妥单抗(Naxitamab)Danyelza在治疗复发性或难治性骨或骨髓高危神经母细胞瘤方面展现了重要的临床价值。了解与其他药物的相互作用无疑是优化治疗效果、保障患者安全的关键。定期的监测与合理的用药管理将有助于提升治疗的成功率和患者的生活质量。 [ 详情 ]已帮助950人2025-10-30 17:08:29
-
问那昔妥单抗(Naxitamab)Danyelza功效与作用主要有哪些答那昔妥单抗(Naxitamab)Danyelza功效与作用主要有哪些,那昔妥单抗(Naxitamab)是一款针对神经节苷脂GD2的人源化单克隆抗体。在临床试验中,它已显示出对神经母细胞瘤患者的疗效。具体来说,那昔妥单抗通过与肿瘤细胞表面的GD2结合,能够引起抗体介导的细胞毒性反应并激活补体系统,从而达到杀伤肿瘤的效果。在某些临床试验中,那昔妥单抗已显示出对神经母细胞瘤患者的疗效,包括诱导肿瘤细胞发生死亡和抑制肿瘤生长等。那昔妥单抗(Naxitamab),商品名Danyelza,是一种针对神经母细胞瘤的单克隆抗体,主要用于治疗复发性或难治性骨或骨髓高危神经母细胞瘤患者。随着对该疾病治疗方法的深入研究,Naxitamab的功效和作用逐渐受到重视,为患者提供了新的希望。 1. Naxitamab的机制与作用原理 那昔妥单抗是一种人源化的IgG1单克隆抗体,主要通过靶向神经母细胞瘤细胞表面的特异性抗原GD2发挥作用。GD2是一种在神经母细胞瘤细胞上高表达的糖脂类抗原,Naxitamab通过结合GD2抗原,激活机体的免疫系统,增强对肿瘤细胞的免疫反应,进而抑制肿瘤细胞的生长和扩散。 2. 治疗指征与适应人群 Naxitamab主要用于治疗复发性或难治性的骨或骨髓高危神经母细胞瘤患者,尤其是那些对于传统疗法无应答或病情进展的患者。此药物的推出为患者提供了一个新的治疗选择,可能改善他们的生存率和生活质量。 3. 临床效果及试验结果 临床试验显示,那昔妥单抗在治疗高危神经母细胞瘤方面具有令人鼓舞的疗效。研究表明,使用Naxitamab的患者在整体生存率和无进展生存期方面均有显著提高。此外,对于一些极难治愈的患者,Naxitamab的联合疗法也显示出增强的治疗效果。 4. 不良反应与安全性 尽管Naxitamab的疗效显著,但在使用中仍需警惕不良反应的发生。常见的不良反应包括发热、低血细胞计数、皮疹及过敏反应等。在临床应用过程中,医生需密切监测患者的反应,并及时处理可能出现的副作用,以确保治疗的安全性和有效性。 总的来说,那昔妥单抗(Danyelza)为复发性或难治性骨或骨髓高危神经母细胞瘤患者提供了新的治疗选择,其独特的作用机制和良好的临床效果使其成为抗击这一恶性肿瘤的重要武器。随着研究的深入,Naxitamab有望为更多患者带来希望,提高他们的生存质量和生存时间。 [ 详情 ]已帮助1337人2025-10-23 10:18:36
-
问那昔妥单抗(Naxitamab)Danyelza的副作用大不大答那昔妥单抗(Naxitamab)Danyelza的副作用大不大,Danyelza(Naxitamab)的常见副作用包括输液相关反应、疼痛、心动过速、呕吐、咳嗽、恶心、腹泻、食欲下降、高血压、疲劳、多形红斑、周围神经病变、发热、头痛等。其中,输液相关反应最常见,表现为面部、眼、唇、口或舌肿胀、呼吸困难、瘙痒等。此外,长期使用那昔妥单抗还可能导致变态反应。那昔妥单抗(Naxitamab)Danyelza是一种用于治疗复发性或难治性骨或骨髓高危神经母细胞瘤的单克隆抗体药物。作为一种靶向疗法,它通过与癌细胞表面的特定抗原结合,激活免疫系统对抗肿瘤。任何治疗都有可能伴随一定的副作用。那么,Danyelza的副作用到底有多大呢? 1. 常见副作用 在临床应用中,Danyelza的常见副作用包括发热、疲劳、恶心、呕吐以及食欲减退。这些副作用通常是暂时性的,对患者的生活质量影响相对较轻。在大多数情况下,通过对症治疗可以帮助缓解这些不适。 2. 免疫相关副作用 由于Danyelza是通过增强免疫系统来发挥作用,因此某些免疫相关的副作用也可能出现,例如皮疹、过敏反应或其他自身免疫问题。这类副作用可能在治疗过程中出现,医生会根据患者的具体情况进行监测和处理。 3. 严重副作用 虽然Danyelza的大部分副作用是轻微的,但在某些情况下,患者可能会经历更为严重的副作用,比如低血小板症、感染风险增加等。这些情况需要及时和专业的医疗干预,所以患者在接受治疗期间需要定期进行血液检查和身体评估。 4. 剂量与疗程的影响 副作用的发生率和严重程度还与患者的剂量选择和治疗疗程密切相关。通常,医生会根据患者的具体情况制定个性化的治疗方案,以尽量减少副作用的发生。合理的剂量调整有助于在获得更好的治疗效果的同时降低副作用的风险。 虽然那昔妥单抗(Danyelza)可能引发不同程度的副作用,但在大多数情况下,这些副作用是可以管理的。患者在使用该药物治疗复发性或难治性骨或骨髓高危神经母细胞瘤时,应与医生充分沟通,及时报告自身的不适,以确保治疗的安全性与有效性。 [ 详情 ]已帮助954人2025-10-04 13:45:01
-
问那昔妥单抗(Naxitamab)Danyelza儿童用药需要注意什么答那昔妥单抗(Naxitamab)Danyelza儿童用药需要注意什么,Danyelza(Naxitamab)使用时需注意过敏反应、免疫系统抑制、药物相互作用、监测不良反应等。遵循医生建议和指导,不自行调整剂量或停药,若有不适,及时就医。Danyelza(Naxitamab)在儿童患者中的用药需遵循医生的建议和指导。根据适应症,那昔妥单抗主要用于治疗患有骨或骨髓中复发或难治性高危神经母细胞瘤的儿童患者。对于这些患者,可以使用那昔妥单抗与粒细胞-巨噬细胞集落刺激因子(GM-CSF)的联合治疗。在治疗过程中,应密切监测儿童的病情和不良反应,及时调整治疗方案。那昔妥单抗(Naxitamab),商品名Danyelza,是一种针对复发性或难治性骨或骨髓高危神经母细胞瘤患者的单克隆抗体药物。在儿童肿瘤治疗中,其使用越来越受到关注。本文将探讨使用那昔妥单抗(Danyelza)时需要注意的几个方面,以确保儿童患者的安全和治疗效果。 1. 用药适应症与禁忌症 那昔妥单抗主要适用于经其他治疗无效的复发性或难治性神经母细胞瘤患者。在使用之前,必须确保患者符合治疗指征,且没有已知的对该药成分过敏的历史。同时,医疗团队需要评估患者的整体健康状况,以避免因药物相互作用或并发症引发的不良反应。 2. 剂量与给药方式 那昔妥单抗的用药剂量与给药频率根据患者的体重及病情不同而有所不同。医师会根据儿童的具体情况制定个体化方案。注射通常通过静脉进行,治疗期间需要严格按照医嘱进行监测,以确保用药安全。 3. 不良反应的监测 在使用那昔妥单抗的过程中,患者可能会出现一些不良反应,包括发热、皮疹、血小板减少等。因此,家长和医务人员需要对患者的状态进行密切监控,一旦出现异常症状,应及时与医生沟通并采取适当的处理措施。 4. 附加治疗的配合 在治疗过程中,可能需要与其他疗法进行配合,如化疗或放疗等。家长和医生需要充分沟通,了解各类治疗对儿童的整体影响。同时,在进行联合治疗时,务必要关注药物间的相互作用,确保治疗方案的安全性和有效性。 最后,使用那昔妥单抗(Danyelza)治疗儿童高危神经母细胞瘤是一个复杂的过程。对于家长和医疗团队来说,理解药物的特性、注意相关的注意事项和监测并发症,是确保儿童患者获得最佳治疗效果的关键。希望这篇文章能为相关人士提供有价值的信息,促进治疗的顺利进行。 [ 详情 ]已帮助1366人2025-07-22 09:38:34
-
问那昔妥单抗(Naxitamab)Danyelza是什么时候上市的答那昔妥单抗(Naxitamab)Danyelza是什么时候上市的,那昔妥单抗(Naxitamab)于2020年11月25日首次获美国食品药品监督管理局(FDA)加速批准上市。国内目前未上市。那昔妥单抗(Naxitamab)Danyelza是一种用于治疗复发性或难治性骨或骨髓高危神经母细胞瘤患者的单克隆抗体药物。这种新药的上市为这些患者提供了新的治疗选择,标志着在儿童癌症治疗领域的重要进展。本文将探讨Danyelza的上市时间及其背景。 1. Danyelza的上市时间 Danyelza于2020年11月被美国食品药品监督管理局(FDA)批准上市。这是一个里程碑式的时刻,因为这款药物的上市为那些面临复发或难治性神经母细胞瘤困扰的儿童患者提供了新的希望。 2. 该药物的适应症 Danyelza的主要适应症为治疗复发性或难治性骨或骨髓的高危神经母细胞瘤。该病是一种常见于婴幼儿的恶性肿瘤,影响神经组织,因此对于患者而言,及时有效的治疗至关重要。 3. 药物机制与作用 那昔妥单抗是一种针对神经母细胞瘤细胞表面抗原GD2的单克隆抗体。通过与GD2结合,Danyelza能够引导免疫系统攻击并杀死肿瘤细胞,显示出良好的治疗潜力和耐受性。 4. 临床试验与研究结果 在临床试验中,Danyelza显示出对复发性或难治性神经母细胞瘤患者的有效性。一些数据表明,使用Danyelza的患者在生存率和肿瘤缩小方面都获得了积极的结果,进一步证实了其在临床应用中的潜力。 通过以上分析,我们可以看到,那昔妥单抗(Naxitamab)Danyelza的上市对复发性或难治性骨或骨髓高危神经母细胞瘤患者而言,具有重要的临床意义。这一新药的推出不仅拓展了治疗选择,也为众多家庭带来了新的希望。 [ 详情 ]已帮助1484人2025-07-04 16:58:24
-
问那昔妥单抗(Naxitamab)Danyelza的使用注意事项有哪些答那昔妥单抗(Naxitamab)Danyelza的使用注意事项有哪些,Danyelza(Naxitamab)使用时需注意过敏反应、免疫系统抑制、药物相互作用、监测不良反应等。遵循医生建议和指导,不自行调整剂量或停药,若有不适,及时就医。Danyelza(Naxitamab)用法为:每4周重复一次,剂量为3mg/kg/天,最多150mg/天。与GM-CSF联合皮下注射给药,直到完全缓解或部分缓解。每个治疗周期的第1、3、5天给药,同时需注意输液相关反应、疼痛等副作用。如有疑问或不适,请及时咨询医生或药师。那昔妥单抗(Naxitamab),商品名Danyelza,是一种用于治疗复发性或难治性高危神经母细胞瘤患者的单克隆抗体药物。作为一种新兴的靶向疗法,Danyelza通过针对特定的癌细胞抗原来发挥作用。使用该药物时需要注意多方面的使用注意事项,以确保患者的安全及治疗效果。 1. 药物适应症 那昔妥单抗主要用于治疗复发性或难治性骨或骨髓高危神经母细胞瘤患者。在使用前,医生需对患者进行全面评估,以确认其符合该药物的适应症。 2. 剂量和给药途径 Danyelza的剂量需要根据患者的体重进行计算,并严格遵循医嘱进行给药。该药物通常通过静脉输注给药,医护人员需要在输注过程中密切观察患者的反应,以便及时处理可能出现的副作用。 3. 可能的副作用 使用那昔妥单抗可能会出现一系列副作用,例如发热、低血压、皮疹等。在治疗开始前,患者及其家属应详细了解这些潜在的副作用,并在治疗过程中,如遇到异常症状要及时向医生报告。 4. 监测和随访 在治疗期间,定期的监测和随访非常重要。医生会根据患者的具体情况,安排相应的检查和评估,以便及时发现和处理不良反应或治疗效果,确保患者的治疗过程顺利进行。 那昔妥单抗(Danyelza)作为一种靶向治疗药物,为复发性或难治性高危神经母细胞瘤患者提供了新的治疗选择。在使用过程中,患者及医护人员需共同参与,遵循相关的使用注意事项,以确保最大限度地提高治疗疗效并降低不良反应的风险。 [ 详情 ]已帮助1193人2025-04-22 16:46:52
-
1金刚马(REPL Hypower Musli)医保报销需要哪些手续已帮助人数1324人2025-12-15 13:49:20
-
2信迪利单抗(Sintilimab)的效果及注意事项有哪些已帮助人数917人2025-12-15 13:48:28
-
3非布司他的副作用有多大已帮助人数1335人2025-12-15 13:40:00
-
4艾伏尼布(Tibsovo)依维替尼耐药性已帮助人数1085人2025-12-15 13:36:35
-
5司美诺肽可以治疗什么病已帮助人数1003人2025-12-15 13:36:15
-
6普纳替尼(lclusig)泊那替尼的用法用量及副作用已帮助人数1070人2025-12-15 13:34:01
-
7印度双效片伐地那非的疗效与作用及副作用已帮助人数1023人2025-12-15 13:30:55
-
8普鲁士蓝(Prussian blue)的副作用和处理措施已帮助人数1119人2025-12-15 13:30:33
-
9莫博赛替尼(LuciMob)Exkivity仿制药效果好吗已帮助人数915人2025-12-15 13:27:35
-
10醋酸地塞米松出现副作用该怎么办已帮助人数1190人2025-12-15 13:24:21
-
11非布司他片的用法已帮助人数1100人2025-12-15 13:24:05
-
12印度神油(Kamsutram Oil)费用多少钱已帮助人数950人2025-12-15 13:18:43