SER-109国内上市时间

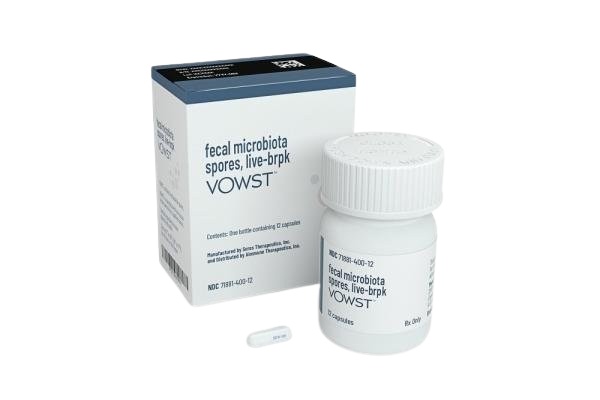
SER-109国内上市时间,SER-109(Fecal Microbiota Spores, live-brpk)于2023年4月27日获得美国食品药品监督管理局(FDA)的批准上市,目前国内未上市。
SER-109是针对艰难梭菌感染(Clostridioides difficile infection, CDI)的一种新型治疗药物,其成分为活性粪便微生物芽孢。随着抗生素的广泛使用,艰难梭菌感染的发生率逐渐上升,成为临床上一个严重的公共卫生问题。SER-109的上市让人们对该疾病的治疗产生了新的希望。本文将探讨SER-109在国内的上市时间及其相关信息。
1. SER-109的基本概念
SER-109是一种以粪便微生物芽孢为基础的疗法,通过重建肠道微生物群来帮助患者恢复健康。它主要用于治疗难治性艰难梭菌感染,特别是那些对常规抗生素治疗效果不佳的患者。这种创新疗法预计将为广大患有克艰难梭菌感染的患者提供新的选择。
2. 国内上市的背景
近年来,艰难梭菌感染在中国的发病率显著增加,对于传统治疗方法的抗药性问题愈加突出。因此,开发出新型疗法,尤其是针对特定病原体的生物制剂显得尤为重要。SER-109的临床试验结果显示其在治愈率和安全性方面均具有良好的表现,这使得它在中国市场倍受关注。
3. 上市时间的预测
根据目前的资料,SER-109的国内上市时间尚未确定,具体进展依赖于药品注册的审批流程。一般而言,治疗药物在经过临床试验后,需要进行多轮的评估和审查。因此,预计SER-109的上市可能会在2025年或2026年之间,但具体时间仍需关注相关部门的通知与更新。
4. 未来展望
随着SER-109的上市临近,预计将会对艰难梭菌感染的治疗方式带来革命性的改变。除了能够提高治愈率外,SER-109还可能对二次感染的预防起到积极效果。医生和患者们对此充满期待,期待这一创新疗法能早日普及于临床实践中,造福更多患者。
综上所述,SER-109作为一种新的治疗方法,展现出了良好的临床前景。尽管其在国内的上市时间仍不确定,但随着对艰难梭菌感染认识的不断深入,未来其推广应用必将推动疾病治疗的发展。希望相关部门能够加速审批流程,尽快让这一重要的疗法为患者所用。